 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
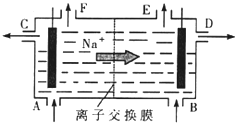
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.(1)如图是离子交换膜法电解饱和食盐水的原理示意图.电解槽中B处加入的水中通常含有少量
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,则产生NaOH
(3)利用氯碱工业产生的氢气和氯气可以将粗硅制成高纯硅,写出反应的化学方程式
(4)氯碱工业常用于电石法生产聚氯乙烯.请写出以电石和氯碱工业的产品为原料制备聚氯乙烯的化学方程式:①CaC2+2H2O→Ca(OH)2+C2 H2↑,②
参考答案:
分析:(1)依据图示中的钠离子的移向方向,分析可知电解池中阳离子移向阴极,所以B处为阴极,溶液中的氢离子放电,生成氢氧化钠,A为阳极溶液中氯离子失电子生成氯气;
(2)依据电极反应和电子守恒分析计算得到;
(3)依据电解食盐水生成的氢气和氯气反应生成的氯化氢和粗硅反应生成三氯氢硅和氢气,氢气在高温下和三氯氢硅反应生成氯化氢和硅,依据化学方程式计算需要的食盐质量;
(4)聚氯乙烯的制备需要制备加成试剂氯化氢,利用乙炔和氯化氢反应生成氯乙烯,在引发条件下发生聚合反应生成聚氯乙烯.
(2)依据电极反应和电子守恒分析计算得到;
(3)依据电解食盐水生成的氢气和氯气反应生成的氯化氢和粗硅反应生成三氯氢硅和氢气,氢气在高温下和三氯氢硅反应生成氯化氢和硅,依据化学方程式计算需要的食盐质量;
(4)聚氯乙烯的制备需要制备加成试剂氯化氢,利用乙炔和氯化氢反应生成氯乙烯,在引发条件下发生聚合反应生成聚氯乙烯.
解答:解:(1)依据图示中的钠离子的移向方向,分析可知电解池中阳离子移向阴极,所以B处为阴极,溶液中的氢离子放电,生成氢氧化钠,B处加入的水中含有氢氧化钠;A为阳极溶液中氯离子失电子生成氯气,F口处放出的是氯气;
故答案为:氢氧化钠,氯气;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
=1.204×1024,
=2mol,电子物质的量=2mol,阴极电极反应为:2H++2e-=H2↑,依据化学方程式和电子守恒分析计算2NaCl+2H2O
2NaOH+H2↑+Cl2↑,转移电子2mol生成氢氧化钠2mol,质量为80g;
故答案为:80,2H++2e-=H2↑;
(3)电解食盐水生成的氢气和氯气,利用反应生成的氯化氢和粗硅反应生成三氯氢硅和氢气,氢气在高温下和三氯氢硅反应生成氯化氢和硅,反应的化学方程式为:Si+2Cl2
SiCl4,SiCl4+2H2
Si+4HCl;依据化学方程式计算需要的食盐物质的量关系,4NaCl~2H2+2Cl2~Si,若生产7吨高纯硅理论上需电解食盐质量设为x,
4NaCl~2H2+2Cl2~Si
4×58.5 28
x 7t
x=58.5t;
故答案为:Si+2Cl2
SiCl4,SiCl4+2H2
Si+4HCl;58.5;
(4)聚氯乙烯的制备需要制备加成试剂氯化氢,利用乙炔和氯化氢反应生成氯乙烯,在引发条件下发生聚合反应生成聚氯乙烯,反应的化学方程式为:H2+Cl2
2HCl,CH≡CH+HCl→CH2=CHCl,nCH2=CHCl→ ;
;
故答案为:H2+Cl2
2HCl,CH≡CH+HCl→CH2=CHCl,nCH2=CHCl→ ;
;
故答案为:氢氧化钠,氯气;
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,电子数=
| 1.929×105C |
| 1.602×10-19C |
| 1.204×1024 |
| 6.02×1023 |
| ||
故答案为:80,2H++2e-=H2↑;
(3)电解食盐水生成的氢气和氯气,利用反应生成的氯化氢和粗硅反应生成三氯氢硅和氢气,氢气在高温下和三氯氢硅反应生成氯化氢和硅,反应的化学方程式为:Si+2Cl2
| ||
| ||
4NaCl~2H2+2Cl2~Si
4×58.5 28
x 7t
x=58.5t;
故答案为:Si+2Cl2
| ||
| ||
(4)聚氯乙烯的制备需要制备加成试剂氯化氢,利用乙炔和氯化氢反应生成氯乙烯,在引发条件下发生聚合反应生成聚氯乙烯,反应的化学方程式为:H2+Cl2
| ||
 ;
;故答案为:H2+Cl2
| ||
 ;
;点评:本题考查了电解原理的分析应用,电解池电极反应判断,化学方程式的计算,掌握基础是解题关键,题目难度中等.
-
科目: 来源: 题型:
查看答案和解析>>(2011•宝鸡一模)[化学选修2--化学与技术]1892年,比利时人索尔维以NaCl、CO2、H2O为原料生产Na2CO3,叫索尔维法.其主要步骤是:
(1)在NH3饱和的NaCl液中通入CO2制得的NaHCO3;
(2)再将NaHCO3焙烧制得纯碱,CO2循环使用;
(3)析出小苏打的母液中加入生石灰,NH2循环使用.
1940年,我国著名化学家侯德榜先生冲破了“索尔维法”技术封锁,并加以改进,用NaCl固体代替生石灰;加入母液使NH4Cl晶体析出,生产出纯碱和氯化铵.这便是举世闻名的“侯氏制碱法”.
试回答:
(1)向母液通入氨气的目的和作用是增大二氧化碳的溶解度增大二氧化碳的溶解度.
(2)在氨饱和NaCl溶液中通入CO2的两步反应方程式为CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4ClCO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl.
(3)不能在NaCl溶液中通入CO2制NaHCO3的原因是CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶.
(4)析出小苏打的母液中加入生石灰的反应方程式是CaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2OCaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.
(5)“侯氏制碱法”与“索尔维法”相比较其优点是使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用. -
科目: 来源: 题型:
查看答案和解析>>(2013•辽宁一模)[化学--选修2化学与技术]
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
已知:①2KOH+C12=KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH=2K2FeO4+6KNO3+2KCl+5H2O
回答下列问题:
(1)该生产工艺应在温度较低温度较低(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取C12的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O;
2NaOH+H2↑+Cl2↑通电 .
(3)K2FeO4可作为新型多功能水处理剂的原因+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是10 mol/L10 mol/L;
(5)在“反应液I”中加KOH固体的目的是①与“反应液I”中过量的Cl2继续反应,生成更多的KClO与“反应液I”中过量的Cl2继续反应,生成更多的KClO②为下一步反应提供反应物为下一步反应提供反应物
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是KNO3、KClKNO3、KCl(写化学式). -
科目: 来源: 题型:
【化学_选修2化学与技术】查看答案和解析>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: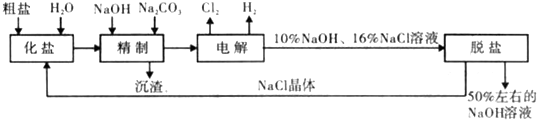
(1)在电解过程中,阳极的电极反应式为与电源负极相连的电极附近.溶液pH 值(选填“不变“、“升髙“或“下降“)
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
,加入除杂试剂的合理顺序为2-4(选填a,b,c多选扣分),沉淀过滤后再加入HCl.
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式.
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.
请分析:①a为(填“阳“或“阴“)离子交换膜;
②从D 口流出的溶液为.(填溶质化学式) -
科目: 来源: 题型:阅读理解
查看答案和解析>>[化学--选修2化学与技术]二氧化硫在工业制硫酸中有着重要作用,但又是煤燃烧的有害气体.按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为.
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为mg•L-1,若规定空气中SO2含量不得超过0.02mg•L-1,则样气是否符合大气的质量标准(填“符合”或“不符合”).
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为.
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是.
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
对于SO2转化SO3的反应,增大压强可使转化率压强MPa
转化率%
温度℃0.1 0.5 1 10 400 99.2 99.6 99.7 99.9 (填“增大”、“减少”或“不变”),但在实际工业生产中常采用常压条件,理由是.
相关试题

