[化学--选修2化学与技术]二氧化硫在工业制硫酸中有着重要作用,但又是煤燃烧的有害气体.按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为 .
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为 mg•L-1,若规定空气中SO2含量不得超过0.02mg•L-1,则样气是否符合大气的质量标准 (填“符合”或“不符合”).
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为 .
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是 .
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
对于SO2转化SO3的反应,增大压强可使转化率 (填“增大”、“减少”或“不变”),但在实际工业生产中常采用常压条件,理由是 .
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
参考答案:
分析:(1)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应;
(2)根据方程式进行计算;
(3)根据化合价变化规律来分析;
(4)A、依据反应物之间的接触面积越大反应速率越快的原理,送进沸腾炉的矿石要粉碎成细小的矿粒,增大矿石跟空气的接触面积,使之充分燃烧;
B、气体中含有杂质能使催化剂发生中毒;
C、依据催化剂改变反应速率不改变化学平衡;
D、若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
(5)根据压强对化学平衡的影响;由题目信息可知根时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
(2)根据方程式进行计算;
(3)根据化合价变化规律来分析;
(4)A、依据反应物之间的接触面积越大反应速率越快的原理,送进沸腾炉的矿石要粉碎成细小的矿粒,增大矿石跟空气的接触面积,使之充分燃烧;
B、气体中含有杂质能使催化剂发生中毒;
C、依据催化剂改变反应速率不改变化学平衡;
D、若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
(5)根据压强对化学平衡的影响;由题目信息可知根时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
解答:解:(1)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,反应方程式为:SO2+Br2+2H2O=2H2SO4+2HBr,故答案为:SO2+Br2+2H2O=2H2SO4+2HBr;
(2)n(e-)=
mol=4×10-6mol,则n(SO2)=
n(e-)=2×10-6mol,m(SO2)=2×10-6mol×64g/mol=1.28×10-4g,SO2的含量为:
=0.64mg/L,不符合大气的质量标准,
故答案为:0.64;不符合;
(3)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,SO2被氧化,则NaClO3被还原降价,生成物种中Cl氧化态低于NaClO3(+5价);向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,Cl2被还原,则NaClO2被氧化升价,生成物种中Cl氧化态高于NaClO2(+3价)则共同物种Cl氧化态为+4,故选:D;
(4)A、增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率,故A错误;
B、气体中含有杂质能使催化剂发生中毒失去活性,不是因为炉气中的SO2会与杂质反应,故B错误;
C、催化剂改变反应速率不改变化学平衡,所以SO2氧化为SO3时需要使用催化剂,这样可以加快其反应速率,不可提高SO2的转化率,故C错误;
D、不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢,故D正确;
故选:D;
(5)对于SO2转化SO3的反应,增大压强可使平衡正向移动,转化率增大,此时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失,
故答案为:增大;常压下,SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
(2)n(e-)=
| 2.408×10 18 |
| 6.02×10 23 |
| 1 |
| 2 |
| 1.28×10-1mg |
| 0.2L |
故答案为:0.64;不符合;
(3)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,SO2被氧化,则NaClO3被还原降价,生成物种中Cl氧化态低于NaClO3(+5价);向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,Cl2被还原,则NaClO2被氧化升价,生成物种中Cl氧化态高于NaClO2(+3价)则共同物种Cl氧化态为+4,故选:D;
(4)A、增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率,故A错误;
B、气体中含有杂质能使催化剂发生中毒失去活性,不是因为炉气中的SO2会与杂质反应,故B错误;
C、催化剂改变反应速率不改变化学平衡,所以SO2氧化为SO3时需要使用催化剂,这样可以加快其反应速率,不可提高SO2的转化率,故C错误;
D、不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢,故D正确;
故选:D;
(5)对于SO2转化SO3的反应,增大压强可使平衡正向移动,转化率增大,此时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失,
故答案为:增大;常压下,SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
点评:本题主要考查二氧化硫的性质,涉及氧化还原反应、化学反应速率、化学平衡等知识,题目难度中等,注意相关基础知识的积累.
-
科目: 来源: 题型:
查看答案和解析>>(2013•兰州一模)[化学--选修2 化学与技术]
活性ZnO在橡胶、塑料、涂料工业中有广泛的应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
已知:
(1)碱式碳酸锌(Zn2 (OH)2CO3)经焙烧可制得活性ZnO
(2)几种离子生成氢氧化物沉淀时的pH如下表:
请问答下列问题:待沉淀离子 Fe2+ Fe3+ Zn2+ Cu2+ 开始沉淀时pH 6.34 1.48 6.2 5.2 完全沉淀时pH 9.7 3.2 8.0 6.4
(1)浸出过程中提高浸出效率可采用的措施有将粗ZnO矿石粉碎或提高浸取温度或适当增加酸的浓度等将粗ZnO矿石粉碎或提高浸取温度或适当增加酸的浓度等(任答一条即可).
(2)步骤A加H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O2Fe2++H2O2+2H+=2Fe3++2H2O,该步骤需控制溶液pH的范围是3.2~5.23.2~5.2.
(3)步骤B进行的操作名称是沉降、过滤沉降、过滤.步骤C中加入锌粉的目的是除去溶液中的Cu2+杂质除去溶液中的Cu2+杂质.
(4)A溶液中主要含有的溶质是(NH4)2SO4(NH4)2SO4,生成碱式碳酸锌的离子反应的方程式为2Zn2++4HCO3-═Zn2 (OH)2CO3↓+3CO2↑+H2O2Zn2++4HCO3-═Zn2 (OH)2CO3↓+3CO2↑+H2O. -
科目: 来源: 题型:
查看答案和解析>>(2013•辽宁一模)[化学--选修2化学与技术]
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
已知:①2KOH+C12=KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH=2K2FeO4+6KNO3+2KCl+5H2O
回答下列问题:
(1)该生产工艺应在温度较低温度较低(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取C12的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O;
2NaOH+H2↑+Cl2↑通电 .
(3)K2FeO4可作为新型多功能水处理剂的原因+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是10 mol/L10 mol/L;
(5)在“反应液I”中加KOH固体的目的是①与“反应液I”中过量的Cl2继续反应,生成更多的KClO与“反应液I”中过量的Cl2继续反应,生成更多的KClO②为下一步反应提供反应物为下一步反应提供反应物
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是KNO3、KClKNO3、KCl(写化学式). -
科目: 来源: 题型:
【化学--选修2化学与技术】查看答案和解析>>
侯德榜制碱法,也叫联合制碱法,其生产流程可简要表示如下图: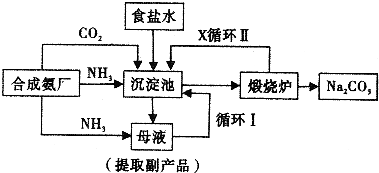
(1)向沉淀池中通入CO2和氨气时,应先通入.原因是.
(2)沉淀池中发生反应的化学反应方程式是;煅烧炉中发生的化学反应方程是.
(3)向母液中通氨气并加入细小食盐颗粒,冷却析出的副产品是,通入氨气的作用是(填选项)
A.增大NH+4的浓度:使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)为提高原料氯化钠的利用率,主要是设计了.(填上述流程中的编号)的循环,物质X是.从沉淀池中分离沉淀的操作是.
(5)CO2是制碱工业的重要原料,侯德耪制碱法和氨碱法中CO2的来源有何不同.
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为. -
科目: 来源: 题型:
查看答案和解析>>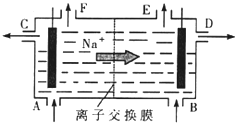 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
(1)如图是离子交换膜法电解饱和食盐水的原理示意图.电解槽中B处加入的水中通常含有少量,F出口逸出的气体是.
(2)已知一个电子的电量是1.602×10-19C,若在离子膜电解饱和食盐水时通过电量1.929×105C,则产生NaOHg,阴极的电极反应式为
(3)利用氯碱工业产生的氢气和氯气可以将粗硅制成高纯硅,写出反应的化学方程式、.若生产7吨高纯硅理论上需电解食盐吨.
(4)氯碱工业常用于电石法生产聚氯乙烯.请写出以电石和氯碱工业的产品为原料制备聚氯乙烯的化学方程式:①CaC2+2H2O→Ca(OH)2+C2 H2↑,②,③,④.
相关试题

