【题目】水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣=Fe3O4+S4O62﹣+2H2O,下列说法中不正确的是
A. 每生成1mol Fe3O4,反应转移的电子总数为4mol
B. Fe2+和S2O32﹣都是还原剂
C. x=4
D. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
参考答案:
【答案】D
【解析】
A. 3Fe2+~O2~Fe3O4~4e-,每生成1molFe3O4,反应转移的电子总数为4mol,故A正确;B. Fe2+的铁元素化合价升高,S2O32﹣的硫元素化合价升高,故B正确;C. 根据电荷守恒可得x=4,故C正确;D. 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol,故D正确。故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述正确的是

A.Mg(s)所具有的能量高于MgX2(s)所具有的能量
B.MgCl2电解制Mg(s)和Cl2(g)是吸热过程
C.热稳定性:MgI2>MgBr2>MgCl2>MgF2
D.常温下氧化性:F2<Cl2<Br2<I2
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。

请回答:
(1)黄色溶液中的金属阳离子是________。
(2)固体A→白色沉淀B的离子方程式是______________________________。
(3)X的化学式是_____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
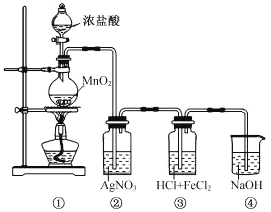
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)如图所示的模型表示的分子中,可由A、D形成的是____。


c与氯气反应生成的二元取代物有____种,d分子的结构简式____。
(2)Na在F单质中燃烧产物的电子式为____。该燃烧产物中化学键的类型为:____。上述元素的最高价氧化物的水化物中,碱性最强的是____(写化学式)。
(3)A与D组成的化合物中,质量相同,在氧气中完全燃烧消耗氧气最多的是:____
(4)关于(1)中d分子有下列问题:
①d分子中同一平面的原子最多有____个。
②若用-C4H9取代d上的一个H原子,得到的有机物的同分异构体共有____种。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
相关试题

