【题目】某研究小组利用下图所示实验装置(部分加持装置已略去)制备无水CuCl2,并对实验过程中污染性气体进行处理。已知CuCl2易潮解。请回答以下问题:
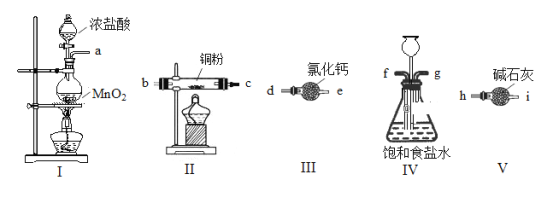
(1)用上图五个装置制取CuCl2,其连接顺序为______________(按气流方向,用小写字母表示)。
(2)装置I中发生反应的离子方程式为_____________________________________。
(3)装置III干燥管中氯化钙的作用是______________________________。
(4)实验开始时,先点燃装置________(填“I”或“II”)处的酒精灯。
(5)本实验中,用如图装置VI代替装置V是否可行______________(填 写“可行”或“不可行”)

(6)实验结束后,先关闭装置I处分液漏斗活塞, 再关闭装置IV的g处(用止水夹夹住),此时装置IV中长颈漏斗的作用是_________。
参考答案:
【答案】afgdebch(i ) MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 I 不可行 储存多余氯气
Mn2++Cl2↑+2H2O 除去氯气中的水蒸气 I 不可行 储存多余氯气
【解析】
先用装置I制备氯气,氯气中含有氯化氢,气体从f进入饱和食盐水中除去氯化氢,从g口流出,然后用氯化钙干燥氯气,从d口进,e口出,干燥的氯气与铜在装置II中加热反应,因为CuCl2易潮解,氯气有毒,因此用装置V既可以吸收氯气,又可以防止水蒸气进入装置II中,结合以上分析解答。
(1)先用装置I制备氯气,氯气中含有氯化氢,气体从f进入饱和食盐水中除去氯化氢,从g口流出,然后用氯化钙干燥氯气,从d口进,e口出,干燥的氯气与铜在装置II中加热反应,因为CuCl2易潮解,氯气有毒,因此用装置V既可以吸收氯气,又可以防止水蒸气进入装置II中,结合以上分析可知,用上图五个装置制取CuCl2,其连接顺序为afgdebch(i );综上所述,本题答案是:afgdebch(i )。
(2)二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;综上所述,本题答案是:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;综上所述,本题答案是:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(3)结合以上分析可知,装置III干燥管中氯化钙的作用是除去氯气中的水蒸气;综上所述,本题答案是:除去氯气中的水蒸气。
(4)为防止铜与氧气反应,实验前,先用氯气排净装置内的空气,因此实验开始时,先点燃装置I处的酒精灯;
综上所述,本题答案是:I。
(5)生成物氯化铜易潮解,必须隔绝水蒸气,氢氧化钠溶液虽然能够吸收氯气,但是会有水蒸气产生,因此不能用VI代替装置V;综上所述,本题答案是:不可行。
(6)实验结束后,装置内会有残留的氯气,因此装置IV中长颈漏斗的作用是储存多余氯气;综上所述,本题答案是:储存多余氯气。
-
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应N2+3H2
 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是A. 3v正(N2)=v正(H2)B. 2v正(N2)=v逆(NH3)
C. v正(N2)=3v逆(H2)D. 2v正(H2)=3v逆(NH3)
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于元素周期表的叙述,错误的是( )
A. 镁是第IIA族元素
B. 第IA族元素全部是金属元素
C. O族中无金属元素
D. 第3周期中既有金属元素又有非金属元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,不属于可逆反应的是( )
A. 2NO2=N2O4与N2O4=2NO2B. H2+I2
 2HI与2HI
2HI与2HI H2+I2
H2+I2C. CO2+H2O=H2CO3与H2CO3=CO2↑+H2OD. CaO+CO2=CaCO3与CaCO3
 CaO+CO2↑
CaO+CO2↑ -
科目: 来源: 题型:
查看答案和解析>>【题目】(1).将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)
 2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:温度/℃
15.0
20.0
25.0
30.0
35.0
平衡气体总浓度/
(×10-3mol·L-1)
2.4
3.4
4.8
6.8
9.4
①氨基甲酸铵分解反应的焓变△H__________0(填">"或"<)
②可以判断该分解反应已经达到化学平衡的是__________(填字母);
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为__________.
(2).已知25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol·L-1氨水的pH约为__________(已知lg3≈0.5)。在某MgCl2溶液中加入一定量的某浓度的氨水后,测得混合液的pH=11,则此温度下残留在溶液中的c(Mg2+)=__________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】能区别NaCl,AgNO3,Na2CO3三种溶液的最适宜的试剂为( )
A.氯化钙B.氢氧化钠溶液C.稀硝酸D.稀盐酸
相关试题

