【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为__________________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_______________________________________________________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次_________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
参考答案:
【答案】 Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ S 防止溶液倒吸 若SO2过量,溶液显酸性,产物会分解 ADCB 品红溶液 装置C中品红溶液不褪色,B中澄清石灰水变浑浊 氯化钡溶液、盐酸
【解析】(1)A装置用亚硫酸钠与浓硫酸制备二氧化硫气体,发生的反应为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;C装置中二氧化硫与硫化钠反应:Na2S+H2O+SO2=Na2SO3+H2S,2H2S+SO2=3S↓+2H2O,S单质使溶液浑浊,S(s)+Na2SO3(aq)![]() Na2S2O3(aq),因此溶液澄清;(2)根据B装置的特点可判断B装置用来防止倒吸;由题可知,硫代硫酸钠遇酸易分解,SO2过量,溶液显酸性,产物分解;(3)①硫代硫酸钠遇酸易分解:S2O32-+2H+=H2O+SO2↑+S↓,若有碳酸钠:CO32-+2H+=H2O+CO2↑,A中应为酸溶液,需排除二氧化硫的干扰,二氧化硫有还原性,所以选用酸性高锰酸钾溶液除去,再用二氧化硫的漂白性,用品红溶液检验二氧化硫是否除净,最后再用澄清石灰水验证二氧化碳的生成;因此实验装置的连接顺序依次为ADCB;②根据以上分析可知证明固体中含有碳酸钠的实验现象是装置C中品红溶液不褪色,B中澄清石灰水变浑浊;(4)检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成,Na2SO3与BaCl2溶液混合有亚硫酸钡白色沉淀生成,故先用氯化钡溶液,再向沉淀中加稀盐酸,生成的气体用品红溶液检验即可。
Na2S2O3(aq),因此溶液澄清;(2)根据B装置的特点可判断B装置用来防止倒吸;由题可知,硫代硫酸钠遇酸易分解,SO2过量,溶液显酸性,产物分解;(3)①硫代硫酸钠遇酸易分解:S2O32-+2H+=H2O+SO2↑+S↓,若有碳酸钠:CO32-+2H+=H2O+CO2↑,A中应为酸溶液,需排除二氧化硫的干扰,二氧化硫有还原性,所以选用酸性高锰酸钾溶液除去,再用二氧化硫的漂白性,用品红溶液检验二氧化硫是否除净,最后再用澄清石灰水验证二氧化碳的生成;因此实验装置的连接顺序依次为ADCB;②根据以上分析可知证明固体中含有碳酸钠的实验现象是装置C中品红溶液不褪色,B中澄清石灰水变浑浊;(4)检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成,Na2SO3与BaCl2溶液混合有亚硫酸钡白色沉淀生成,故先用氯化钡溶液,再向沉淀中加稀盐酸,生成的气体用品红溶液检验即可。
-
科目: 来源: 题型:
查看答案和解析>>【题目】除去NaCl中含有的Ca2+、Mg2+、SO42﹣、HCO3﹣等离子,通常采用以下四种试剂:①Na2CO3②BaCl2③NaOH ④HCl,加入试剂合理的操作顺序是( )
A.①②③④
B.③①②④
C.④②①③
D.③②①④ -
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)
 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是A. v正(X)=v逆(Z)
B. 容器内压强不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1 mol X的同时生成0.2 mol Z
-
科目: 来源: 题型:
查看答案和解析>>【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
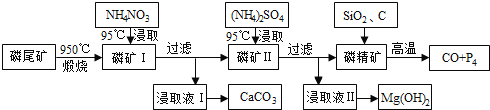
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
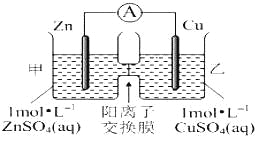
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列指定反应的离子方程式正确的是
A. 氯化铁溶液溶解铜片:Fe3++ Cu=Fe2++ Cu2+
B. 氯气与水反应:Cl2 + H2O
 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-C. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O=AgOH↓+ NH4+
D. Ca(HCO3)2溶液与少量NaOH溶液反应: Ca2++ HCO3-+ OH-=CaCO3↓+ H2O
相关试题

