【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
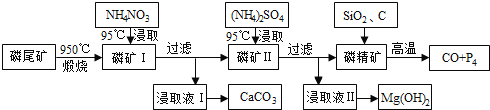
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
参考答案:
【答案】
(1)高于;
(2)NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+(或H+与CaO、Ca(OH)2反应生成Ca2+);CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+
(3)Ca5(PO4)3F
(4)CO+O2-2e-=CO2;石墨Ⅱ;
(5)①d;②减小
【解析】
试题分析:磷尾矿[主要含Ca5(PO4)3F和CaCO3MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4。
2CaF2+30CO+18CaSiO3+3P4。
(1)根据流程图,在950℃煅烧是磷精矿[Ca5(PO4)3F]未分解,因此磷精矿的分解温度高于950℃,故答案为:高于;
(2)NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+;CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+,因此第一次浸取液用NH4NO3而不用的(NH4)2SO4,故答案为:NH4+水解使溶液呈酸性,H+能从磷矿I中浸取出Ca2+;CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+;
(3)根据流程图,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4,反应中P元素化合价降低,被还原,被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
2CaF2+30CO+18CaSiO3+3P4,反应中P元素化合价降低,被还原,被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
(4)石墨Ⅰ为负极,电极反应式为CO+O2-2e-=CO2;原电池中阳离子向正极移动,因此Na+向石墨Ⅱ移动,故答案为:CO+O2-2e-=CO2;石墨Ⅱ;
(5)①a.常温下,水的离子积常数c(H+)·c(OH-)=1×10-14,正确;b.根据质子守恒,有c(H+)+c(HCOOH)=c(OH-),正确;c.根据物料守恒有c(Na+)=c(HCOOH)+c(HCOO-),正确;d.HCOONa溶液水解显碱性,水解程度一般较小,c(Na+)>c(HCOO-) >c(H+)>c(OH-),错误;故选d;
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,促进水解,c(HCOO-) 减小,温度不变,水解常数不变,K=![]() , c(HCOOH)·c(OH-)减小,故答案为:减小。
, c(HCOOH)·c(OH-)减小,故答案为:减小。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于苯酚的叙述中,正确的是
A.呈弱酸性,使石蕊试液显浅红色 B.分子中的13个原子有可能处于同一平面
C.可以和NaHCO3溶液反应产生气体 D.能与FeCl3溶液反应生成紫色沉淀a
-
科目: 来源: 题型:
查看答案和解析>>【题目】电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是含Cr2O72-工业废水的电化学处理示意图。下列说法正确的是(己知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
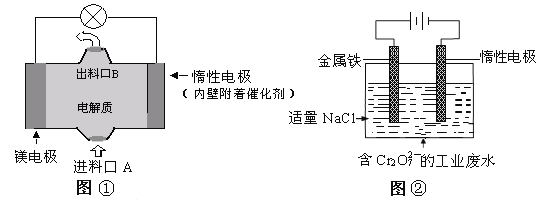
A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②中阳极上的电极反应式为:Fe-3e-=Fe3+
C. 图①中发生的还原反应是:ClO-+H2O+2e-=Cl-+2OH-
D. 若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可产生32.1g氢氧化铁沉淀
-
科目: 来源: 题型:
查看答案和解析>>【题目】某充电电池的原理如图所示,溶液中c(H+)=2.0mol·L-1,阴离子为SO42-,a、b均为情性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是( )

A. 放电过程中,左槽溶液颜色由黄色变为蓝色
B. 充电过程中,a极的反应式为:VO2++2H++e-=VO2++H2O
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 放电时,当转移1.0mol电子时共有2.0molH+从左槽迁移进右槽
-
科目: 来源: 题型:
查看答案和解析>>【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列说法正确的是

A.图2电池放电过程中,Na+从正极区向负极区迁移
B.图2电池负极区的电极反应为BH4-― 8e- + 8OH-=BO2- + 6H2O
C.若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
-
科目: 来源: 题型:
查看答案和解析>>【题目】氯碱工业中离子交换膜电解槽示意图如下图,其中的离子交换膜为“阳离子交换膜”,它有一特殊的性质:只允许阳离子通过,而阻止阴离子和气体通过。下列说法正确的是()
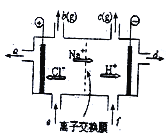
A. e口流入的是精制食盐水;f口流入的是蒸馏水
B. a口流出的是稀食盐水,d口流出的是氢氧化钠溶液
C. b为氯气,c为氧气
D. b与a口流出的溶液可制得漂白液
-
科目: 来源: 题型:
查看答案和解析>>【题目】《验方新编》中有如下叙述:“凡暑月身热昏沉,未明症候,恐是出丹。用生白扁豆数粒食之. 如不知腥味,则以生白扁豆、水泡湿,研汁一小杯,调水一盏服之。即愈。”文中涉及的操作方法是
A. 蒸馏 B. 升华 C. 浸取 D. 分液
相关试题

