【题目】按要求填空
(1)天然气的主要成分是_____(写化学式),其分子空间构型是_____;
(2)苯与液溴在铁粉为催化剂时发生反应的化学方程式_____;反应类型为_____;
(3)写出Na与水反应的离子方程式_____;
(4)CH2=CH﹣CH=CH2与H2在一定条件下发生1,4﹣加成反应的化学方程式_____;
(5)萘的结构简式是![]() ,其分子式_____;一氯代物有_____种。
,其分子式_____;一氯代物有_____种。
(6)某摩尔质量为42gmol﹣1的链烃A可使溴水褪色,A的结构简式为_____;A在一定条件下可以发生加聚反应,产物的结构简式为_____。
参考答案:
【答案】CH4 正四面体型 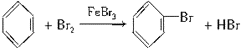 取代反应 2Na+2H2O=2Na++2OH﹣+H2 CH2=CH﹣CH=CH2+H2
取代反应 2Na+2H2O=2Na++2OH﹣+H2 CH2=CH﹣CH=CH2+H2![]() CH3﹣CH=CH﹣CH3 C10H8 2 CH2=CH﹣CH3
CH3﹣CH=CH﹣CH3 C10H8 2 CH2=CH﹣CH3 ![]()
【解析】
(1)天然气的主要成分为甲烷,为正四面体结构,故答案为:CH4;正四面体型;
(2)苯与液溴在铁粉为催化剂时发生取代反应生成溴苯,方程式为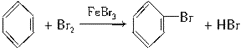 ,
,
故答案为: ;取代反应;
;取代反应;
(3)钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH﹣+H2,故答案为:2Na+2H2O=2Na++2OH﹣+H2;
(4)CH2=CH﹣CH=CH2与H2在一定条件下发生1,4﹣加成反应生成CH3﹣CH=CH﹣CH3,反应的方程式为CH2=CH﹣CH=CH2+H2一定条件CH3﹣CH=CH﹣CH3,故答案为:CH2=CH﹣CH=CH2+H2![]() CH3﹣CH=CH﹣CH3;
CH3﹣CH=CH﹣CH3;
(5)![]() 分子中含有10个C、8个H原子,分子式为C10H8,分子中有2种H,则一氯代物有2种,
分子中含有10个C、8个H原子,分子式为C10H8,分子中有2种H,则一氯代物有2种,
故答案为:C10H8 ;2;
(6)摩尔质量为42gmol﹣1的链烃A可使溴水褪色,含有碳碳双键,应为CH2=CH﹣CH3,可发生加聚反应生成聚丙烯,方程式为CH2=CH﹣CH3![]()
![]() ,故答案为:CH2=CH﹣CH3 ,
,故答案为:CH2=CH﹣CH3 ,![]() 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列离子方程式的书写及评价,均合理的是
选项
离子方程式
评价
A
用铜电极电解饱和KCl溶液:2H2O+2Cl-
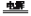 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-正确:Cl-的失电子能力比OH-强
B
向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+
错误:H2S的酸性比H2SO4弱
C
Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O
错误:Ba2+与HCO3-系数比应为1:2
D
过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3-
正确:H2SO3的酸性比HClO强
A.AB.BC.CD.D
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是H2 和Cl2 反应生成HCl的能量变化示意图,由图可知( )
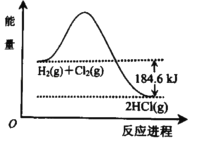
A. 反应物的能量总和小于生成物的能量
B. 生成1molHCl(g)需吸收92.3kJ的能量
C. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJmol﹣1
D. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJ
-
科目: 来源: 题型:
查看答案和解析>>【题目】某溶液中可能含有K+、Na+、Fe2+、Fe3+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
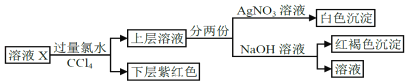
A. “下层紫红色”为I2的CCl4溶液,可用分液方法分离
B. 溶液X中有Fe2+、I﹣,可能有SO42﹣、Cl﹣、K+、Na+
C. 溶液X中一定有I﹣、Cl﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
-
科目: 来源: 题型:
查看答案和解析>>【题目】A是一种重要的化工原料,部分性质及转化关系如图:
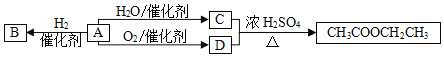
请回答:
(1)D中官能团的名称是_____。
(2)A→B的反应类型是_____。
A.取代反应B.加成反应C.氧化反应
(3)写出A→C反应的化学方程式_____。
(4)下列说法不正确的是_____。
A.B物质不能使溴水和酸性高锰酸钾褪色
B.A在一定条件下可与氯化氢发生加成反应
C.有机物C、D可用金属钠鉴别
D.A分子所有原子在同一个平面内
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
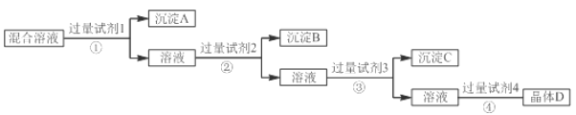
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室需要0.1 mol·L-1 NaOH溶液490mL。根据溶液的配制情况回答下列问题。
(1)配制上述溶液需要的玻璃仪器有烧杯、玻璃棒、量筒、__________、__________。
(2)配制时,正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶液
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于__________、后用于__________。
(4)报据计算用托盘天平称取NaOH固体的质量为__________g。
相关试题

