【题目】分子式为C4H9Cl的同分异构体(不含对映异构)有
A.2种B.3种C.4种D.5种
参考答案:
【答案】C
【解析】
C4H10有两种结构,一种为正丁烷,其一氯代物有2种,另一种为异丁烷,其一氯代物有2种,故分子式为C4H9Cl的同分异构体共有4种;
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO32Zn(OH)2的一种工艺如下:
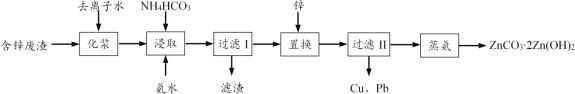
(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是____。
(2)浸取时的温度控制在30 ℃,原因是____。浸取后,ZnO转化为[Zn(NH3)4]CO3溶液,滤渣的主要成分为____。
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为_____mol·L-1。
(4)蒸氨时发生反应的化学方程式为____。
(5)本工艺中可循环利用的物质为____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(
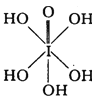 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一种酸性溶液中可能存在 NO3-、I- 、Cl- 、Fe3+ 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
A. 可能会有Fe3+ B. 一定会有 NO3-
C. 一定含有I- ,不能确定是否含Cl- D. 一定含有I- 、NO3-和Cl-
-
科目: 来源: 题型:
查看答案和解析>>【题目】绿水青山就是金山银山,研究NO2, NO,CO,SO2 等大气污染物和温室效应的治理对建设美丽中国具有重要意义。
(1)已知:NO2(g)+CO(g)
 CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为NO2,
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
②N2(g)+O2(g)═2NO(g)△H=+179.5kJmol1 k2
③2NO(g)+O2(g)═2NO2(g)△H=112.3kJmol1 k3
写出NO与CO反应生成无污染气体的热化学方程式为____________.该热化学方程式的平衡常数K为______________(用K1。K2。K3表示)。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)在体积可变的恒压密闭容器中充入1molCO2与足量的碳,让其发生反应:C(s)+CO2(g)
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
T℃时,若容器中充入惰性气体,v正 ______ v逆(填<,>,=),平衡______移动(填正向,逆向或不。下同),若充入等体积的CO2和CO,平衡_________移动。
650℃时,反应达平衡后CO2的转化率为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一种以含钴废催化剂(含Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体与黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:
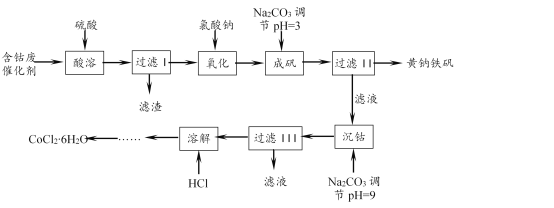
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
(1)“氧化”“成矾”需在加热条件下进行。“氧化”时反应的离子方程式为____。实验中能否选用KMnO4溶液检验Fe2+是否完全氧化,____(填“能”或“不能”),理由是____。
(2)该条件下,若用H2O2作氧化剂,实际H2O2的用量比理论用量要多,重要原因之一是H2O2发生了分解。该条件下H2O2分解较快的原因是:① ____;②____。
(3)成矾过程中反应的离子方程式为____。检验成矾是否完全的实验操作是____。
相关试题

