【题目】一种以含钴废催化剂(含Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体与黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:
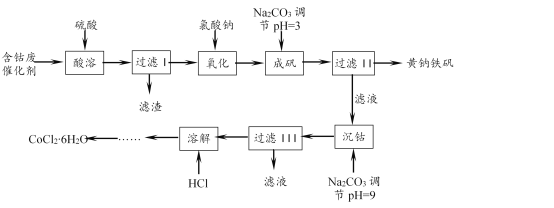
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
(1)“氧化”“成矾”需在加热条件下进行。“氧化”时反应的离子方程式为____。实验中能否选用KMnO4溶液检验Fe2+是否完全氧化,____(填“能”或“不能”),理由是____。
(2)该条件下,若用H2O2作氧化剂,实际H2O2的用量比理论用量要多,重要原因之一是H2O2发生了分解。该条件下H2O2分解较快的原因是:① ____;②____。
(3)成矾过程中反应的离子方程式为____。检验成矾是否完全的实验操作是____。
参考答案:
【答案】6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O
6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
【解析】
根据流程中发生的理化变化、结合物质的性质、应用化学反应原理解答问题。
(1)含钴废催化剂经“酸溶”、“过滤I”所得滤液中有FeSO4、Fe2(SO4)3等,而“过滤II”所得黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+3价。故“氧化”是将Fe2+变成Fe3+,反应的离子方程式为6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
(2)用H2O2氧化Fe2+时,H2O2分解较快。从影响反应速率的因素分析原因:“氧化”在加热条件下进行,温度升高,H2O2分解速率加快; Fe2+或Fe3+的催化作用使H2O2分解速率加快。
(3)“成矾”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12],其中Fe3+ 、SO42- 来自氧化后的溶液、Na+ 来自NaClO3和Na2CO3、OH-只能来自CO32-水解。反应的离子方程式为 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。
Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分子式为C4H9Cl的同分异构体(不含对映异构)有
A.2种B.3种C.4种D.5种
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一种酸性溶液中可能存在 NO3-、I- 、Cl- 、Fe3+ 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
A. 可能会有Fe3+ B. 一定会有 NO3-
C. 一定含有I- ,不能确定是否含Cl- D. 一定含有I- 、NO3-和Cl-
-
科目: 来源: 题型:
查看答案和解析>>【题目】绿水青山就是金山银山,研究NO2, NO,CO,SO2 等大气污染物和温室效应的治理对建设美丽中国具有重要意义。
(1)已知:NO2(g)+CO(g)
 CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2(g)+NO(g) 该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为NO2,
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
②N2(g)+O2(g)═2NO(g)△H=+179.5kJmol1 k2
③2NO(g)+O2(g)═2NO2(g)△H=112.3kJmol1 k3
写出NO与CO反应生成无污染气体的热化学方程式为____________.该热化学方程式的平衡常数K为______________(用K1。K2。K3表示)。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)在体积可变的恒压密闭容器中充入1molCO2与足量的碳,让其发生反应:C(s)+CO2(g)
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
T℃时,若容器中充入惰性气体,v正 ______ v逆(填<,>,=),平衡______移动(填正向,逆向或不。下同),若充入等体积的CO2和CO,平衡_________移动。
650℃时,反应达平衡后CO2的转化率为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
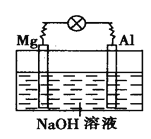
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
-
科目: 来源: 题型:
查看答案和解析>>【题目】在2L密闭容器中,发生3A(g)+B(g)
 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
相关试题

