【题目】从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO32Zn(OH)2的一种工艺如下:
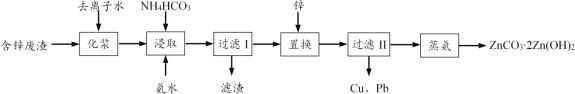
(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是____。
(2)浸取时的温度控制在30 ℃,原因是____。浸取后,ZnO转化为[Zn(NH3)4]CO3溶液,滤渣的主要成分为____。
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为_____mol·L-1。
(4)蒸氨时发生反应的化学方程式为____。
(5)本工艺中可循环利用的物质为____。
参考答案:
【答案】增大接触面积,加快浸取速率,提高锌元素的浸出率(答出任意一点即可) 温度太低,浸取反应速率慢;温度太高,NH4HCO3分解(NH3的溶解度减小) Fe(OH)3、SiO2 8.010-23 3[Zn(NH3)4]CO3 + 2H2O![]() ZnCO32Zn(OH)2 + 12NH3+ 2CO2 NH3(多写CO2不扣分)
ZnCO32Zn(OH)2 + 12NH3+ 2CO2 NH3(多写CO2不扣分)
【解析】
根据流程中发生的物理、化学变化,应用化学反应的相关原理,分析解答问题。
(1)将含锌废渣粉碎并制成悬浊液(化浆),可增大浸取时固液接触面积,加快浸取速率,提高锌元素的浸出率。
(2)浸取时使用NH4HCO3和氨水,若温度过高,NH4HCO3会分解、氨溶解度会减小;若温度过低,浸取反应速率慢。浸取时,ZnO转化为[Zn(NH3)4]CO3溶液,杂质Cu2+、Pb2+经置换、过滤II被除去,则杂质Fe3+、SiO2经浸取、过滤I被除去。废渣中的SiO2不溶于NH4HCO3和氨水,Fe3+在碱性浸取液中形成Fe(OH)3沉淀。故滤渣的主要成分为SiO2、Fe(OH)3。
(3)若用(NH4)2S使Cu2+、Pb2+生成硫化物沉淀。因Ksp(CuS)<Ksp(PbS),当c(S2-)相同时,c(Cu2+)<c(Pb2+),故以Ksp(PbS)计算。要c(Pb2+)<1.0×10-5 mol·L-1,代入其溶度积的表达式可以计算出c(S2-)>8.0×10-23mol·L-1 。
(4)过滤II的滤液中含[Zn(NH3)4]CO3,蒸氨时生成NH3、ZnCO32Zn(OH)2,发生非氧化还原反应。据元素守恒,写出配平的方程式3[Zn(NH3)4]CO3 + 2H2O![]() ZnCO32Zn(OH)2 + 12NH3↑+ 2CO2↑。
ZnCO32Zn(OH)2 + 12NH3↑+ 2CO2↑。
(5)“蒸氨”时生成的氨气可用于“浸取”,可循环利用的物质为NH3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
 CH3OCH3(g)+
CH3OCH3(g)+ 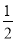 H2O(1)的ΔH =
H2O(1)的ΔH = kJmol-1
kJmol-1D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?)
 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(
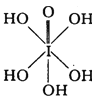 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分子式为C4H9Cl的同分异构体(不含对映异构)有
A.2种B.3种C.4种D.5种
相关试题

