
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。
【答案】1 890 > 350 40%
【解析】
(1)在质量一定的情况下,平均相对分子质量与气体的分子数成反比。
(2)在相同的温度和相同的体积条件下,压强之比等于气体的物质的量之比。
(3)该反应的特点是正向气体分子数减小,所以恒温恒压和恒温恒容相比,相当于加压;
(4)计算该温度下的平衡常数,根据表格中平衡常数和温度的关系判断;
(1)该反应是一个正向放热的反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小。平均相对分子质量的减小则说明反应物中气体计量数之和大于生成物的,即3>a+1,a作为正整数,只能为1;
(2)同一温度同一容器中,气体的分子数之于其物质的量之比,当反应达到平衡时容器内的压强减少了10%,则分子数目减少了10%,气体的物质的量也就减少10%,即气体的物质的量减少(4 mol +6 mol)×10%=1mol,根据反应式2X(g)+Y(g)![]() Z(g)+W(g),当气体的物质的量减少1mol时,参加反应的X的物质的量是2mol,则反应中放出的热量为890kJ;
Z(g)+W(g),当气体的物质的量减少1mol时,参加反应的X的物质的量是2mol,则反应中放出的热量为890kJ;
(3)该反应是一个正向气体分子数减小的反应,在相同的温度时,恒压与恒容相比,相当于增大压强。增大压强该反应的平衡向正反应方向移动,则X的质量分数将变小,所以容器中X的质量分数M>N;
(4)2molX和1molY在容器M中反应并达到平衡时,X的转化率为50%,则平衡时:
c(X)=(1-50%)×2mol÷1L=1mol/L;
c(Y)=0.5c(X)=0.5mol/L;
c(Z)=c(W)=c(Y)=0.5mol/L;
所以K=(0.5×0.5)÷(0.5×12)=0.5,所以其温度是350℃。平衡时X的体积分数为:
1mol/L÷(1+0.5+0.5+0.5)mol/L=40%。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
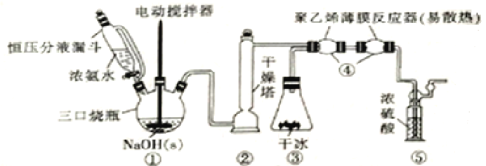
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.08mol;
③第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有___________离子,其物质的量浓度为________。
(2)由第三份进行的实验可知12.54克沉淀的成分是______________(写沉淀化学式),其物质的量分别为______________________。
(3)原溶液中是否存在K+_______填“是”或“否)若存在则K+的浓度的取值范围是____________________(若不存在此空可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计的蔗糖水解反应如图所示(夹持装置省略)。下列说法错误的是( )
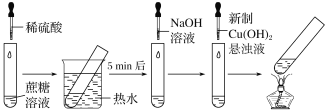
A.稀硫酸和热水浴都能加快蔗糖水解速率
B.滴加NaOH溶液的目的是调溶液的pH至碱性
C.加热至沸腾后试管内生成黑色沉淀
D.实验现象证明蔗糖水解有还原性物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q均为短周期元素,其原子半径与主要化合价的关系如图所示。下列说法正确的是( )

A.X为锂元素
B.原子序数:M<Q
C.最高价含氧酸酸性:Z<M
D.Y、Z简单氢化物的沸点:Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1 ①
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1 ②
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:_____________
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则乙醇燃烧的热化学方程式为____________________________。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:______________________________________________。
(4)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com