
【题目】扁桃酸衍生物是重要的医药中间体。以A和B为原料合成扁桃酸衍生物F的路线如图:
(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为__。B分子式为C6H6O,写出A+B→C的化学反应方程式:__。
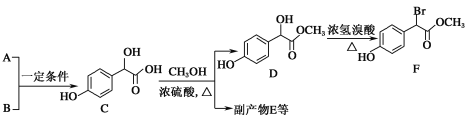
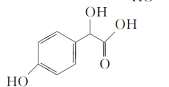
(2)C(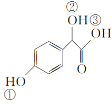 )中①、②、③3个—OH的酸性由强到弱的顺序是__。
)中①、②、③3个—OH的酸性由强到弱的顺序是__。
(3)1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为__mol。符合下列条件的F的同分异构体(不考虑立体异构)共有___种。
①能与碳酸氢钠溶液反应②苯环上只有2个取代基,其中一个是羟基
(4)已知:R—CH2—COOH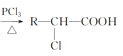 ,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)___。
,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)___。
合成路线流程图示例如下:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5

【答案】醛基、羧基 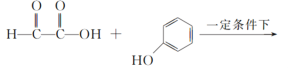
 ③>①>② 3 12 CH3COOH
③>①>② 3 12 CH3COOH
【解析】
A分子式为C2H2O3,可发生银镜反应,且具有酸性,则A是OHC-COOH;根据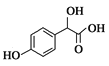 逆推,B是
逆推,B是![]() 。
。
(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A是OHC-COOH,所含官能团名称为醛基、羧基;B分子式为C6H6O,根据C逆推,B是![]() , A+B→C的化学反应方程式是
, A+B→C的化学反应方程式是
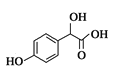 ;
;
(2)C(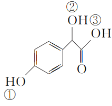 )中①是酚羟基、②是醇羟基、③是羧基,3个—OH的酸性由强到弱的顺序是③>①>②;
)中①是酚羟基、②是醇羟基、③是羧基,3个—OH的酸性由强到弱的顺序是③>①>②;
(3)1mol 在一定条件下与足量NaOH溶液反应生成1mol
在一定条件下与足量NaOH溶液反应生成1mol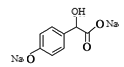 、1molNaBr,最多消耗NaOH的物质的量为3mol;
、1molNaBr,最多消耗NaOH的物质的量为3mol;  的同分异构体,①能与碳酸氢钠溶液反应说明含有羧基,②苯环上只有2个取代基,其中一个是羟基,符合条件的2个取代基分别是-OH、-CHBrCH2COOH或-OH、-CH2CHBrCOOH或-OH、-CBr(CH3)COOH或-OH、-CH(CH2Br)COOH,每种组合有邻间对三种位置异构,符合条件的结构共12种;
的同分异构体,①能与碳酸氢钠溶液反应说明含有羧基,②苯环上只有2个取代基,其中一个是羟基,符合条件的2个取代基分别是-OH、-CHBrCH2COOH或-OH、-CH2CHBrCOOH或-OH、-CBr(CH3)COOH或-OH、-CH(CH2Br)COOH,每种组合有邻间对三种位置异构,符合条件的结构共12种;
(4)乙酸在PCl3加热条件下生成![]() ,
,![]() 水解为
水解为![]() ,
,![]() 酸化生成
酸化生成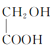 ,
,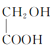 氧化为
氧化为![]() ,合成路线流程为CH3COOH
,合成路线流程为CH3COOH 。
。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献,![]() 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________形。
(2)![]() 中
中![]() 的配位数为4。
的配位数为4。
①配体中![]() 原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
②![]() 的立体构型是________;与
的立体构型是________;与![]() 互为等电子体的分子和离子为________(各写一种)。
互为等电子体的分子和离子为________(各写一种)。
(3)![]() 是钴的重要化合物。
是钴的重要化合物。![]() 键角小于
键角小于![]() 的键角,原因是________。
的键角,原因是________。
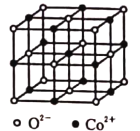
(4)一氧化钴的晶胞如图所示,在每个![]() 的周围与它距离最近的
的周围与它距离最近的![]() 共有________个,若
共有________个,若![]() 晶体的密度为
晶体的密度为![]() ,则晶体中
,则晶体中![]() 与
与![]() 之间的最小距离为________
之间的最小距离为________![]() 。(用含
。(用含![]() 和
和![]() 的代数式表示。
的代数式表示。![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
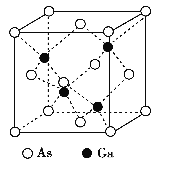
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe2+的核外电子排布式__。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有__和__。1molK4[Fe(CN)6]含有σ键为__mol。
(3)黄血盐中N原子的杂化方式为__;C、N、O的第一电离能由大到小的排序为__,电负性由大到小的排序为__。
(4)Fe、Na、K的晶体结构如图所示:
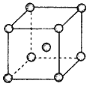
①钠的熔点比钾更高,原因是__。
②Fe原子半径是rcm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,正确的是( )

A.常温下水很稳定(1000℃以上才会部分分解),因为水中含有大量氢键
B.![]() 该分子含有1个手性碳原子
该分子含有1个手性碳原子
C.含有极性键的分子一定是极性分子
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了5种元素在周期表中的位置。
| ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是________,⑤的原结构示意图是________________;
(2)以上元素中,金属性最强的是________________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈________性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是__________(填元素符号);
(5)元素③与元素⑤形成的化合物的名称是________________;
(6)少量元素③的单质通常保存在________中(填“煤油”或“水”);
(7)元素①与元素②的单质氧化性较强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
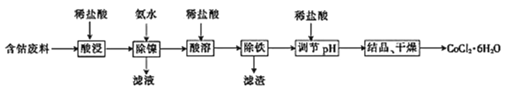
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
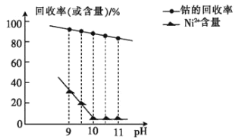
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com