【题目】已知反应:①KClO3 + HCl-----Cl2↑+ KCl + H2O
②Cl2+2KI═2KCl+I2
③I2+5Cl2+6H2O═2HIO3+10HCl
回答下列问题:
(1)反应③中氧化产物是__________(填化学式)
(2)配平反应①并用单线桥法表示该反应中电子转移的方向和数目___KClO3 + ___HCl=_____Cl2↑+____ KCl + ____H2O,______________。
(3)下列说法正确的是______。
A. 反应③中氧化剂和还原剂的物质的量之比为1:5
B.结合反应②③,若将Cl2通入含有淀粉的KI溶液中,可能会观察到先变蓝后褪色
C.还原性由强到弱顺序:Cl-> I-
D.氧化性由强到弱顺序:KClO3>Cl2>I2
(4)实验室用反应①可以制取Cl2,若反应消耗24.5g KClO3,则至少需用________mL 6mol/LNaOH溶液吸收产生的氯气。写出吸收氯气的离子方程式:______________。
参考答案:
【答案】HIO3 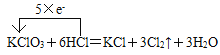 BD 200mL Cl2+2OH-=Cl-+ClO-+H2O
BD 200mL Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)在③I2+5Cl2+6H2O═2HIO3+10HCl反应中,I2失去电子,被氧化变为HIO3,所以I2是还原剂,HIO3是氧化产物;
(2) 在①中,Cl元素的化合价由KClO3中的+5价变为Cl2中的0价,化合价降低,获得5e-,Cl元素的化合价由HCl中的-1价变为Cl2中的0价,化合价升高,失去5×e-,所以KClO3系数是1,KCl系数是1,Cl2系数是3,由于还有一个Cl原子化合价没变,反应后仍然是-1价,与K+结合,所以HCl系数是5+1=6,根据H原子守恒,可得H2O的系数是3,配平后的方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O;用单线桥法表示该反应中电子转移的方向和数目是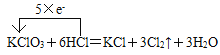 ;
;
(3)A.在③I2+5Cl2+6H2O═2HIO3+10HCl中,I2作还原剂失去电子,Cl2作氧化剂获得电子,氧化剂和还原剂的物质的量之比为5:1,A错误;
B.根据②③可知,当向含有淀粉的KI溶液中通入少量Cl2时,置换出I2,I2能使淀粉溶液变为蓝色;若Cl2过量,I2又被过量Cl2氧化产生HIO3,从而使淀粉溶液又变为无色,B正确;
C.由于氧化性:Cl2> I2,物质的氧化性越强,其相应的离子还原性就越弱,所以还原性由强到弱顺序:I- >Cl- ,C错误;
D.根据①可知氧化性:KClO3>Cl2;根据②可知氧化性:Cl2> I2,所以氧化性:KClO3>Cl2> I2,D正确;
故合理选项是BD;
(4) 用反应①KClO3+6HCl=KCl+3Cl2↑+3H2O制取氯气,n(KClO3)=![]() ,则n(Cl2)=3n(KClO3)=3×0.2mol=0.6mol;Cl2被NaOH溶液吸收,根据2NaOH+Cl2=NaCl+NaClO+H2O可知n(NaOH)=2n(Cl2)=2×0.6mol=1.2mol,则V(NaOH)=
,则n(Cl2)=3n(KClO3)=3×0.2mol=0.6mol;Cl2被NaOH溶液吸收,根据2NaOH+Cl2=NaCl+NaClO+H2O可知n(NaOH)=2n(Cl2)=2×0.6mol=1.2mol,则V(NaOH)=![]() =200mL;吸收氯气的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
=200mL;吸收氯气的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
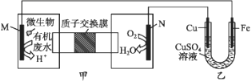
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-
 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】在H2S的饱和溶液中存在下列平衡:①H2S
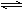 H++HS-,②HS-
H++HS-,②HS- H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是
H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是A. 加NaOH B. 通入H2S气体
C. 降温 D. 加入Na2S晶体
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液最好的方法是_______(写出具体实验操作,结论)。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是_____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得到21.525g白色沉淀。则溶液中c(Cl-)=______mol/L。
③验证该溶液中是否含有Fe2+,正确的实验方法是_____________。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入氯水再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
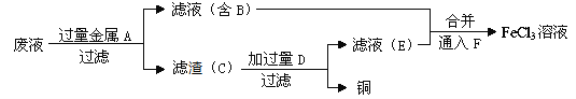
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣C的化学式为_________________。
②加过量D发生反应的离子方程为_____________________________________。
③通入F发生反应的离子方程式为 ____________________________________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,分子数为NA的CO2、N2O混合气体体积约为22.4L,质量为44克
B. 常温常压下,16gO2所含的原子数为NA
C. 由O2和NO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D. 标准状况下,22.4LH2O所合的分子数为NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
-
科目: 来源: 题型:
查看答案和解析>>【题目】同温同压下,相同体积的两种气体A、B的质量比为22:17,若A气体为CO2,则B气体可能是
A. NH3 B. H2S C. SO2 D. O2
相关试题

