【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:
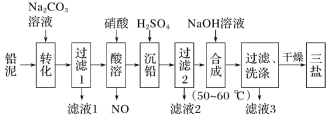
已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是__。
(2)酸溶时,不直接使用H2SO4溶液的原因可能是__;铅与硝酸在酸溶过程中发生反应的离子方程式为__。
(3)流程中可循环利用的物质是__;洗涤操作时,检验沉淀是否洗涤干净需要的试剂是__。
(4)当沉淀转化达平衡时,滤液l中c(![]() )与c(
)与c(![]() )的比值为__。
)的比值为__。
(5)50~60℃时合成三盐的化学方程式为__;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__。
参考答案:
【答案】将PbSO4转化为PbCO3,提高铅的利用率 生成的PbSO4为难溶物,阻碍反应持续进行 ![]() HNO3 盐酸、BaCl2溶液 1.25×105 4PbSO4+6NaOH
HNO3 盐酸、BaCl2溶液 1.25×105 4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O 51.75%
3PbOPbSO4H2O+3Na2SO4+2H2O 51.75%
【解析】
以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
(1)向铅泥中加Na2CO3溶液,由题可知PbCO3的溶解度小于PbSO4的溶解度,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),则可将PbSO4转化成PbCO3,提高铅的利用率,故答案为:将PbSO4转化为PbCO3,提高铅的利用率;
(2)因硫酸铅难溶于水,不能加入硫酸酸溶,否则生成的PbSO4为难溶物,阻碍反应持续进行,铅与硝酸反应生成Pb(NO3)2和NO、H2O的离子方程式为:![]() ,故答案为:生成的PbSO4为难溶物,阻碍反应持续进行;
,故答案为:生成的PbSO4为难溶物,阻碍反应持续进行;![]() ;
;
(3)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用,检验沉淀是否洗涤干净的方法是取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净,故答案为:HNO3;盐酸、BaCl2溶液;
(4)当沉淀转化达平衡时,滤液l中![]() 与
与![]() 的比值为二者对于铅盐溶度积之比,为
的比值为二者对于铅盐溶度积之比,为![]() ,故答案为:1.25×105;
,故答案为:1.25×105;
(5)步骤⑥合成三盐的化学方程式为:4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:
3PbOPbSO4H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:![]() ,设铅泥中铅元素的质量分数为w,则200.0t铅泥中铅元素为200×w,铅泥中的铅元素有80%转化为三盐,有200×w×80%=82.8,解得x=51.75%,故答案为:4PbSO4+6NaOH
,设铅泥中铅元素的质量分数为w,则200.0t铅泥中铅元素为200×w,铅泥中的铅元素有80%转化为三盐,有200×w×80%=82.8,解得x=51.75%,故答案为:4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O;51.75%。
3PbOPbSO4H2O+3Na2SO4+2H2O;51.75%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____(填“相同”或“不相同”)。PO43-的空间结构为___________。
(3)石墨可用作锂离子电池的负极材料,Li+嵌人石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________;若每个六元环都对应一个L i+,则化学式为___________。

(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________(用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________nm。

-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下含碳各微粒H2CO3、
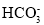 和
和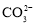 存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )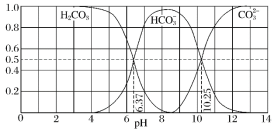
A.pH=10.25时,c(Na+)=c(
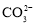 )+c(
)+c(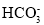 )
)B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D.若是0.1molNaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(
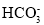 )>c(
)>c(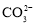 )>c(OH-)>c(H+)
)>c(OH-)>c(H+) -
科目: 来源: 题型:
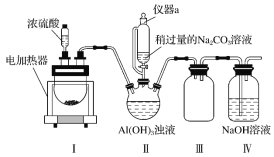
查看答案和解析>>【题目】冰晶石又名六氟铝酸钠(Na3AlF6),白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na3AlF6的装置图如图(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4
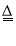 CaSO4+2HF↑
CaSO4+2HF↑(1)装置Ⅲ的作用为__。
(2)在实验过程中,装置Ⅱ中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子方程式:__。
(3)在实验过程中,先向装置Ⅱ中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和Al(OH)3混合后再通入HF气体,其原因是__。
(4)装置Ⅱ反应后的混合液经过过滤可得到Na3AlF6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是__。
(5)萤石中含有少量的Fe2O3杂质,可用装置Ⅰ反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0g萤石加入装置Ⅰ中,完全反应后,将混合液加水稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当出现__现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为__。(已知:I2+2
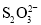 =
=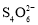 +2I-)
+2I-) -
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活、环境密切相关,下列说法错误的是
A.生活中钢铁制品生锈主要是由于发生吸氧腐蚀所致
B.石油的裂化、裂解和煤的干馏都属于化学变化
C.焚烧废旧塑料可有效防止“白色污染”
D.工业废水中的
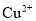 、
、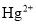 等重金属阳离子可以通过加入
等重金属阳离子可以通过加入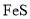 除去
除去 -
科目: 来源: 题型:
查看答案和解析>>【题目】用下列实验装置进行相应的实验,能达到实验目的的是
A.
 所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验B.
 所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性C.
 所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物D.
 所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
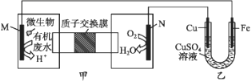
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-
 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
相关试题

