【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
参考答案:
【答案】玻璃棒 2CuI+8HNO3(浓)![]() 2Cu(NO3)2+4NO2↑+I2+4H2O 5.6 Fe3I8 Fe3I8+8NaHCO3
2Cu(NO3)2+4NO2↑+I2+4H2O 5.6 Fe3I8 Fe3I8+8NaHCO3![]() Fe3O4+8NaI+8CO2↑+4H2O 4.68
Fe3O4+8NaI+8CO2↑+4H2O 4.68
【解析】
碘废液加入亚硫酸钠和饱和硫酸铜溶液,发生氧化还原反应生成CuI固体,加入浓硝酸,可得到碘,然后加入铁粉和水,得到含铁化合物B,化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,则应为Fe3I8,加入碳酸氢钠溶液可得到NaI溶液,同时得到黑色固体Fe3O4,滤液经蒸发、结晶得到NaI固体,以此解答该题。
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、玻璃棒,玻璃棒用于引流;
(2)反应③中CuI被氧化生成硝酸铜和单质碘,还原产物只有NO2,该反应的化学方程式为2CuI+8HNO3(浓)=2Cu(NO3)2+4NO2↑+I2+4H2O,当有95.5g CuI参与反应,即n(CuI)=95.5g÷191g/mol=0.5mol,由方程式可知生成1molNO2,则通入氧气发生反应4NO2+2H2O+O2=4HNO3,消耗0.25mol氧气,标况下的体积为0.25mol×22.4L/mol=5.6L;
(3)化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,根据原子守恒可知另一种元素为I,则化合物B的化学式为Fe3I8;
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,应为四氧化三铁,无色气体为二氧化碳,则反应⑤的化学方程式为Fe3I8+8NaHCO3=Fe3O4+8NaI+8CO2↑+4H2O;
(5)n(NaI)=12g÷150g/mol=0.08mol,则与足量氯气反应生成0.08molNaCl,则m(NaCl)=0.08mol×58.5g/mol=4.68g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】苏合香醇可以用作食用香精,其结构简式如图1所示。
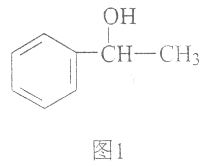
(1)苏合香醇的分子式为_________,它不能发生的有机反应类型有(填数字序号)_________。
①取代反应 ②加成反应 ③消去反应 ④加聚反应
⑤氧化反应 ⑥水解反应
(2)有机物丙是一种香料,其合成路线如图2。其中A为烃,相对分子质量为56;甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物。
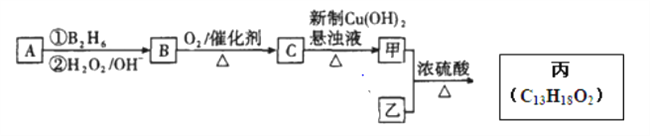
图2
已知:R-CH=CH2
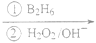 R-CH2CH2OH
R-CH2CH2OHR-CHO
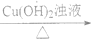 R-COOH
R-COOH①A的名称是_________。
②写出由B到C的化学反应方程式_________。
③B的同分异构体能与钠反应生成氢气,不能发生催化氧化反应,其结构简式为__________________。
④丙中含有两个-CH3,则甲与乙反应的化学方程式为__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】19世纪中叶,俄国化学家门捷列夫的突出贡献是 ( )
A. 提出原子学说 B. 提出分子学说 C. 发现元素周期律 D. 发现氧气
-
科目: 来源: 题型:
查看答案和解析>>【题目】标准状况下,三个干燥烧瓶分别盛①干燥纯净的氨气、②二氧化氮与氧气的混合气(体积比:V(NO2 ):V(O2 )=4:1)、③一半空气的氯化氢,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制乙烯时,产生的气体能使溴水褪色,甲、乙同学用下列实验验证。
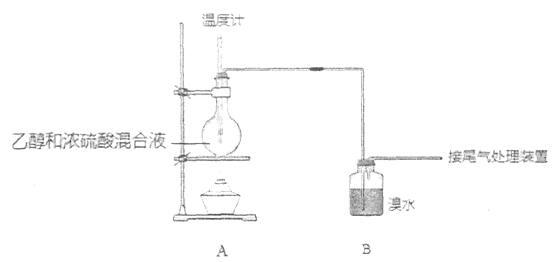
(气密性已检验,部分夹持装置略)。实验操作和现象为:
操作
现象
点燃酒精灯,加热至170℃
I:A中烧瓶内液体渐渐变黑
II:B内气泡连续冒出,溶液逐渐褪色
……
实验完毕,清洗烧瓶
III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出
(1)烧瓶内产生乙烯的化学方程式是________。
(2)溶液“渐渐变黑”,说明浓硫酸具有________性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是________。
②乙根据现象III认为产生了SO2,在B中与SO2反应使溶液褪色的物质是________。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计
现象
甲
在A、B间增加一个装有某种试剂的洗气瓶
溴水褪色
乙
与A连接的装置如下:
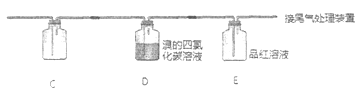
D中溶液由红棕色变为浅红棕色时,E中溶液褪色
a. 根据甲的设计,洗气瓶中盛放的试剂是________。
b. 根据乙的设计,C中盛放的试剂是________。
c. 能证明确实是SO2使E中溶液褪色的实验是________。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是________。
(4)上述实验得到的结论是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
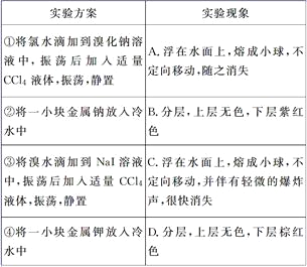
请你帮助该同学整理并完成实验报告。
(1)实验目的:_____________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳等;
②仪器:________、________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):________

(4)实验结论:__________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A.用25 mL量筒量取12.36 mL盐酸
B.用托盘天平称量8.7 g食盐
C.用100 mL的量筒量取18.8 mL NaOH溶液
D.实验室常用的广泛pH试纸测得某溶液的pH为3.5
相关试题

