第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6.图甲、图乙分别是水蒸气液化、水电解的微观示意图,据图回答下列问题。
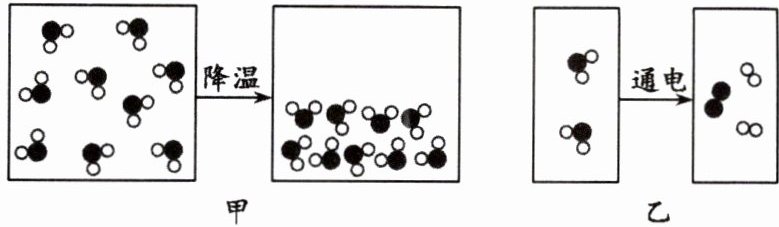
(1)从物质分类看,水不属于
A.混合物
B.氧化物
C.纯净物
D.化合物
(2)从微观角度解释图甲和图乙的本质区别:
(3)图乙所示的变化中,一定不变的是

(1)从物质分类看,水不属于
A
(填字母)。A.混合物
B.氧化物
C.纯净物
D.化合物
(2)从微观角度解释图甲和图乙的本质区别:
图甲中水分子不发生变化,图乙中水分子变为另外两种新的分子(或其他合理答案)
。(3)图乙所示的变化中,一定不变的是
氢
元素和氧
元素,发生改变的粒子是水
分子。
答案:
(1)A (2)图甲中水分子不发生变化,图乙中水分子变为另外两种新的分子(或其他合理答案) (3)氢 氧 水
1. 化学式。
(1) 概念:用元素符号和数字的组合表示
(2) 意义(以化学式 $ {H_{2}O} $ 为例):
|宏观视角|表示一种物质|表示
| |表示物质由什么元素组成|表示
|微观视角|表示构成物质的 1 个分子|表示

| |表示物质的分子构成|表示
(3) 书写方法。
①单质:稀有气体、金属和固态非金属单质的化学式用元素符号表示(碘用 $ {I_{2}} $ 表示等例外),如氦气
②化合物:化合物名称中已读出原子个数的,按后读先写的顺序直接写,如五氧化二磷
(1) 概念:用元素符号和数字的组合表示
物质组成
的式子,叫作化学式。(2) 意义(以化学式 $ {H_{2}O} $ 为例):
|宏观视角|表示一种物质|表示
水
这种物质|| |表示物质由什么元素组成|表示
水由氢元素和氧元素组成
||微观视角|表示构成物质的 1 个分子|表示
1 个水分子
|
| |表示物质的分子构成|表示
1 个水分子由 2 个氢原子和 1 个氧原子构成
|(3) 书写方法。
①单质:稀有气体、金属和固态非金属单质的化学式用元素符号表示(碘用 $ {I_{2}} $ 表示等例外),如氦气
He
、铁Fe
、碳C
;气态非金属的化学式是在元素符号的右下角写上表示分子中所含原子数的数字,如氧气O₂
、臭氧O₃
、氮气N₂
。②化合物:化合物名称中已读出原子个数的,按后读先写的顺序直接写,如五氧化二磷
P₂O₅
;未读出原子个数的,可根据元素的化合价来书写。
答案:
(1)物质组成 (2)水 水由氢元素和氧元素组成 1 个水分子 1 个水分子由 2 个氢原子和 1 个氧原子构成 (3)①He Fe C O₂ O₃ N₂ ②P₂O₅
2. 化合价。
(1) 表示方法。
通常标注在元素符号或原子团(作为整体参加反应)的正上方,“1”不能省略。例如: $ \overset{+1}{{H}}_{2}\overset{-2}{{O}}_{4} $。
(2) 常见规律。
①在单质里,元素的化合价为
②在化合物里,正、负化合价的代数和为 0。
③在化合物里,H 通常为
④一些元素在不同物质中可显不同的化合价。例如: $ \overset{+2}{{CO}} $、 $ \overset{+4}{{CO}}_{2} $。
(3) ①根据化合价书写化学式。可简单记忆为:正价先,负价后,约简交叉定个数,写右下(“1”省略不写),验正误。如氧化铜
②根据化学式,求某些元素的化合价。
$ 化合价 \xleftarrow[化合物里各元素的化合价的代数和为 0]{} 化学式 $
重点解析
粒子符号(M)周围数字(n)的意义:
① $ nM $:只表示微观意义。若 M 是元素符号,如 $ 2{H} $ 表示 2 个氢原子;若 M 是化学式,如 $ 2{SO_{3}} $ 表示 2 个三氧化硫分子;若 M 是离子符号,如 $ 2{Mg^{2+}} $ 表示 2 个镁离子。
② $ {M_{n}} $:n 表示每个分子所含原子的个数。如 $ {H_{2}O} $:2 表示 1 个 $ {H_{2}O} $ 分子中有 2 个 H 原子。
③ $ {M^{n+}} ({M^{n-}}) $: $ n + (n -) $ 表示每个离子所带的正(负)电荷数。如 $ {Al^{3+}} $,3+表示 1 个 $ {Al^{3+}} $ 带 3 个单位正电荷; $ {SO^{2-}_{4}} $,2 - 表示 1 个 $ {SO^{2-}_{4}} $ 带 2 个单位负电荷。
④ $ \overset{+n}{{M}} $(或 $ \overset{-n}{{M}} $)表示 M 的化合价为 +n 价(或 -n 价)。
3. 物质组成的定量认识。(以 $ {H_{2}SO_{4}} $ 为例)
组成物质的各元素之间存在定量关系。相对分子质量是化学式中各原子的
(1) 计算相对分子质量。
$ M_{r}({H_{2}SO_{4}}) = 1 × 2 + 32 + 16 × 4 = 98 $
(2) 计算物质组成元素的质量比。
$ \begin{aligned} m({H}) : m({S}) : m({O}) &= (1 × 2) : 32 : (16 × 4) \\ &= 1 : 16 : 32 \end{aligned} $
(3) 计算物质中某元素的质量分数(符号为 w)。
$ 某元素的质量分数 = \frac{该元素的相对原子质量(A_{r}) × 原子个数}{化合物的相对分子质量(M_{r})} × 100\% $
$ \begin{aligned} w({S}) &= \frac{A_{r}({S}) × 1}{M_{r}({H_{2}SO_{4}})} × 100\% \\ &= \frac{32 × 1}{98} × 100\% \\ &\approx 32.7\% \end{aligned} $
(1) 表示方法。
通常标注在元素符号或原子团(作为整体参加反应)的正上方,“1”不能省略。例如: $ \overset{+1}{{H}}_{2}\overset{-2}{{O}}_{4} $。
(2) 常见规律。
①在单质里,元素的化合价为
0
。②在化合物里,正、负化合价的代数和为 0。
③在化合物里,H 通常为
+1
价,O 通常为-2
价。④一些元素在不同物质中可显不同的化合价。例如: $ \overset{+2}{{CO}} $、 $ \overset{+4}{{CO}}_{2} $。
(3) ①根据化合价书写化学式。可简单记忆为:正价先,负价后,约简交叉定个数,写右下(“1”省略不写),验正误。如氧化铜
$\stackrel{+2}{Cu}\stackrel{-2}{O}$
、氢氧化钠$\stackrel{+1}{Na}\stackrel{-1}{OH}$
、硫酸铝$\stackrel{+3}{Al_2}(\stackrel{-2}{SO_4})_3$
。②根据化学式,求某些元素的化合价。
$ 化合价 \xleftarrow[化合物里各元素的化合价的代数和为 0]{} 化学式 $
重点解析
粒子符号(M)周围数字(n)的意义:
① $ nM $:只表示微观意义。若 M 是元素符号,如 $ 2{H} $ 表示 2 个氢原子;若 M 是化学式,如 $ 2{SO_{3}} $ 表示 2 个三氧化硫分子;若 M 是离子符号,如 $ 2{Mg^{2+}} $ 表示 2 个镁离子。
② $ {M_{n}} $:n 表示每个分子所含原子的个数。如 $ {H_{2}O} $:2 表示 1 个 $ {H_{2}O} $ 分子中有 2 个 H 原子。
③ $ {M^{n+}} ({M^{n-}}) $: $ n + (n -) $ 表示每个离子所带的正(负)电荷数。如 $ {Al^{3+}} $,3+表示 1 个 $ {Al^{3+}} $ 带 3 个单位正电荷; $ {SO^{2-}_{4}} $,2 - 表示 1 个 $ {SO^{2-}_{4}} $ 带 2 个单位负电荷。
④ $ \overset{+n}{{M}} $(或 $ \overset{-n}{{M}} $)表示 M 的化合价为 +n 价(或 -n 价)。
3. 物质组成的定量认识。(以 $ {H_{2}SO_{4}} $ 为例)
组成物质的各元素之间存在定量关系。相对分子质量是化学式中各原子的
相对原子质量
的总和,符号为 $ M_{r} $。(1) 计算相对分子质量。
$ M_{r}({H_{2}SO_{4}}) = 1 × 2 + 32 + 16 × 4 = 98 $
(2) 计算物质组成元素的质量比。
$ \begin{aligned} m({H}) : m({S}) : m({O}) &= (1 × 2) : 32 : (16 × 4) \\ &= 1 : 16 : 32 \end{aligned} $
(3) 计算物质中某元素的质量分数(符号为 w)。
$ 某元素的质量分数 = \frac{该元素的相对原子质量(A_{r}) × 原子个数}{化合物的相对分子质量(M_{r})} × 100\% $
$ \begin{aligned} w({S}) &= \frac{A_{r}({S}) × 1}{M_{r}({H_{2}SO_{4}})} × 100\% \\ &= \frac{32 × 1}{98} × 100\% \\ &\approx 32.7\% \end{aligned} $
答案:
2.(2)①0 ③+1 -2 (3)①$\stackrel{+2}{Cu}\stackrel{-2}{O}$ $\stackrel{+1}{Na}\stackrel{-1}{OH}$ $\stackrel{+3}{Al_2}(\stackrel{-2}{SO_4})_3$ 3. 相对原子质量
查看更多完整答案,请扫码查看


