18. (10分)二氧化碳可通过催化剂转化成液体燃料甲醇($CH_{3}OH$),其微观示意图如图所示(图中的微观粒子恰好完全反应):
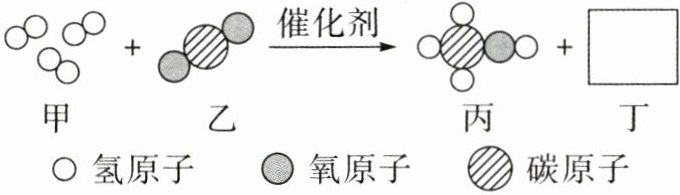
(1)丁的化学式是 。
(2)写出该反应的化学方程式: 。
(3)甲醇中碳元素与氢元素的质量比为 。
(4)从微观的角度分析,甲醇的分子构成可描述为 。
(5)从微观角度分析,该反应前后一定不变的是 (填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量

(1)丁的化学式是 。
(2)写出该反应的化学方程式: 。
(3)甲醇中碳元素与氢元素的质量比为 。
(4)从微观的角度分析,甲醇的分子构成可描述为 。
(5)从微观角度分析,该反应前后一定不变的是 (填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
答案:
(1)H₂O
(2)CO₂+3H₂$\frac{\underline{催化剂}}{}$CH₃OH+H₂O
(3)3:1
(4)1个甲醇分子是由1个碳原子、4个氢原子和1个氧原子构成的(合理即可)
(5)①③⑥
(1)H₂O
(2)CO₂+3H₂$\frac{\underline{催化剂}}{}$CH₃OH+H₂O
(3)3:1
(4)1个甲醇分子是由1个碳原子、4个氢原子和1个氧原子构成的(合理即可)
(5)①③⑥
19. (8分)新情境 嫦娥五号 (2024·山东菏泽东明期末)中国探月工程“绕”“落”“回”三步走规划如期完成。“嫦娥五号”带回的月壤中含有大量的钛铁矿。科学家设想的有关人类利用月壤资源的流程图如下(甲烷符号为$CH_{4}$)。
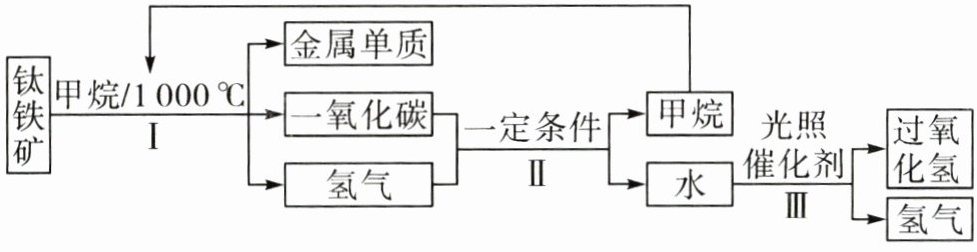
(1)步骤Ⅰ中获得的金属单质有 (写出其中一种金属的化学式)。
(2)步骤Ⅱ中发生反应的化学方程式为 。
(3)步骤Ⅲ的反应所属的基本反应类型是 (填“化合反应”或“分解反应”)。
(4)上述流程中可循环使用的物质是 (填化学式)。

(1)步骤Ⅰ中获得的金属单质有 (写出其中一种金属的化学式)。
(2)步骤Ⅱ中发生反应的化学方程式为 。
(3)步骤Ⅲ的反应所属的基本反应类型是 (填“化合反应”或“分解反应”)。
(4)上述流程中可循环使用的物质是 (填化学式)。
答案:
(1)Ti(或Fe)
(2)3H₂+CO$\xlongequal{一定条件}$CH₄+H₂O
(3)分解反应
(4)H₂和CH₄
(1)Ti(或Fe)
(2)3H₂+CO$\xlongequal{一定条件}$CH₄+H₂O
(3)分解反应
(4)H₂和CH₄
20. (10分)Ⅰ. 化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1)。观察到镁条在空气中剧烈燃烧,发出耀眼的白光,产生的大量白烟弥漫到空气中,最后在陶土网上得到了一些白色固体。
 图1
图1
 图2
图2
(1)通过称量发现:在陶土网上收集到的产物的质量小于镁条的质量。你认为出现这一实验结果的原因可能是 。
Ⅱ. 小红按如图2所示的改进装置验证质量守恒定律,发现白色固体中含有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色固体氮化镁($Mg_{3}N_{2}$);
③氮化镁可与水剧烈反应产生氨气($NH_{3}$),氨气具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是$Mg_{3}N_{2}$。
【实验探究】(2)请设计实验,验证猜想。
|实验操作|实验现象|实验结论|
|a. 取少量产物中的黄色固体于试管中,并向其中加入适量的 |①生成具有刺激性气味的气体②试纸由红色变成 色|猜想正确|
|b. 在试管口放置一片湿润的红色石蕊试纸| | |
【反思与交流】(3)空气中氮气和氧气的体积比约为 ,可是镁条在空气中的燃烧产物MgO却远多于$Mg_{3}N_{2}$,合理的解释是 。
 图1
图1 图2
图2(1)通过称量发现:在陶土网上收集到的产物的质量小于镁条的质量。你认为出现这一实验结果的原因可能是 。
Ⅱ. 小红按如图2所示的改进装置验证质量守恒定律,发现白色固体中含有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色固体氮化镁($Mg_{3}N_{2}$);
③氮化镁可与水剧烈反应产生氨气($NH_{3}$),氨气具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是$Mg_{3}N_{2}$。
【实验探究】(2)请设计实验,验证猜想。
|实验操作|实验现象|实验结论|
|a. 取少量产物中的黄色固体于试管中,并向其中加入适量的 |①生成具有刺激性气味的气体②试纸由红色变成 色|猜想正确|
|b. 在试管口放置一片湿润的红色石蕊试纸| | |
【反思与交流】(3)空气中氮气和氧气的体积比约为 ,可是镁条在空气中的燃烧产物MgO却远多于$Mg_{3}N_{2}$,合理的解释是 。
答案:
(1)逸散到空气中的白烟的质量大于消耗的氧气的质量
(2)水 蓝
(3)4:1(或78:21) 氧气比氮气的化学性质活泼,镁更易与氧气反应
[解析]
(1)镁燃烧消耗氧气,生成氧化镁,但反应过程中有白烟产生,若逸散到空气中的白烟的质量大于消耗的氧气的质量,则反应后产物的质量小于镁条的质量。
(2)由于氮化镁能和水反应生成氨气,氨气有刺激性气味,且氨气能使湿润的红色石蕊试纸变蓝色,则取少量产物中的黄色固体于试管中,并向其中加入适量的水,然后在试管口放一片湿润的红色石蕊试纸,由于结论为猜想正确,则现象为生成具有刺激性气味的气体,试纸由红色变成蓝色。
(3)氮气约占空气体积的$\frac{4}{5}$,氧气约占空气体积的$\frac{1}{5}$,所以氮气和氧气的体积比约为4:1;由于氧气的化学性质比氮气的活泼,所以氧气更易与镁发生反应,因此生成的氧化镁远多于氮化镁。
(1)逸散到空气中的白烟的质量大于消耗的氧气的质量
(2)水 蓝
(3)4:1(或78:21) 氧气比氮气的化学性质活泼,镁更易与氧气反应
[解析]
(1)镁燃烧消耗氧气,生成氧化镁,但反应过程中有白烟产生,若逸散到空气中的白烟的质量大于消耗的氧气的质量,则反应后产物的质量小于镁条的质量。
(2)由于氮化镁能和水反应生成氨气,氨气有刺激性气味,且氨气能使湿润的红色石蕊试纸变蓝色,则取少量产物中的黄色固体于试管中,并向其中加入适量的水,然后在试管口放一片湿润的红色石蕊试纸,由于结论为猜想正确,则现象为生成具有刺激性气味的气体,试纸由红色变成蓝色。
(3)氮气约占空气体积的$\frac{4}{5}$,氧气约占空气体积的$\frac{1}{5}$,所以氮气和氧气的体积比约为4:1;由于氧气的化学性质比氮气的活泼,所以氧气更易与镁发生反应,因此生成的氧化镁远多于氮化镁。
查看更多完整答案,请扫码查看


