11. 有元素化合价变化的反应是氧化还原反应。如$C + O_{2}\xlongequal{点燃}CO_{2}$,反应前后C和O元素的化合价发生了变化,该反应是氧化还原反应。下列反应不属于氧化还原反应的是( )。
A.$S + O_{2}\xlongequal{点燃}SO_{2}$
B.$C + 2CuO\xlongequal{高温}2Cu + CO_{2}\uparrow$
C.$2KMnO_{4}\xlongequal{\triangle}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow$
D.$CuSO_{4} + 2NaOH\xlongequal{\;\;}Cu(OH)_{2}\downarrow + Na_{2}SO_{4}$
A.$S + O_{2}\xlongequal{点燃}SO_{2}$
B.$C + 2CuO\xlongequal{高温}2Cu + CO_{2}\uparrow$
C.$2KMnO_{4}\xlongequal{\triangle}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow$
D.$CuSO_{4} + 2NaOH\xlongequal{\;\;}Cu(OH)_{2}\downarrow + Na_{2}SO_{4}$
答案:
D
12. “宏观-微观-符号-量”是科学特有的表征物质及其变化的方法。部分火箭助推器使用偏二甲肼和四氧化二氮作为推进剂,燃烧时发生反应的微观示意图如下,下列说法不正确的是( )。
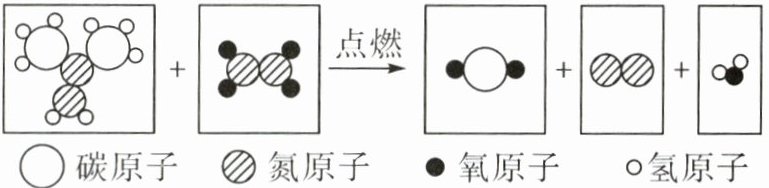
A.从量的角度看:反应前后原子总数减少
B.从微观构成看:氮气是由氮分子构成的
C.从符号表征看:四氧化二氮的化学式是$N_{2}O_{4}$
D.从宏观物质看:燃烧产物中含有单质与化合物两类物质

A.从量的角度看:反应前后原子总数减少
B.从微观构成看:氮气是由氮分子构成的
C.从符号表征看:四氧化二氮的化学式是$N_{2}O_{4}$
D.从宏观物质看:燃烧产物中含有单质与化合物两类物质
答案:
A
13. (2025·陕西渭南蒲城检测)兴趣小组用如图所示实验验证质量守恒定律。下列说法错误的是( )。
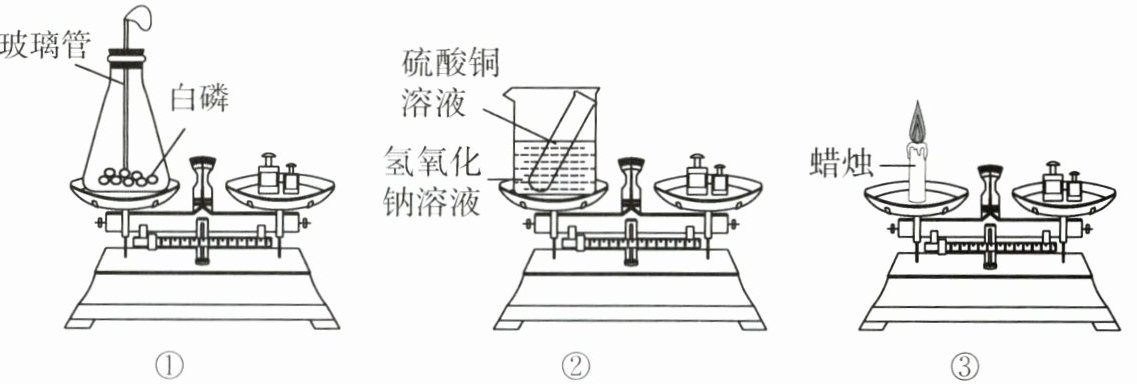
A.不能直接用于验证质量守恒定律的是实验③
B.实验①过程中发现指针向右偏转,原因可能是装置未冷却至室温
C.实验②反应前后天平始终保持平衡
D.实验③蜡烛燃烧时,减少的质量为释放到空气中的水蒸气与二氧化碳质量之和

A.不能直接用于验证质量守恒定律的是实验③
B.实验①过程中发现指针向右偏转,原因可能是装置未冷却至室温
C.实验②反应前后天平始终保持平衡
D.实验③蜡烛燃烧时,减少的质量为释放到空气中的水蒸气与二氧化碳质量之和
答案:
D [解析]实验①白磷燃烧生成五氧化二磷,在密闭装置中进行,可以验证质量守恒定律;实验②氢氧化钠与硫酸铜反应生成氢氧化铜沉淀与硫酸钠,发生了化学变化,没有气体生成可以验证质量守恒定律;实验③蜡烛燃烧生成二氧化碳与水,有气体参加反应、生成,故必须在密闭的环境下进行实验才能验证质量守恒定律。由分析可知,实验③不能验证质量定律,A正确;由分析可知,该反应放热,若装置未冷却至室温,气球膨胀,产生浮力,会导致质量偏小,指针向右偏转,B正确;实验②无气体参加、生成,且符合质量守恒定律,故实验②反应前后天平始终保持平衡,C正确;实验③蜡烛燃烧消耗氧气,生成二氧化碳和水,根据反应前后物质的总质量不变,则固体减少的质量为释放到空气中的水蒸气与二氧化碳的质量总和减去消耗的氧气的质量,D错误。
14. 工业上可用“氨氧化法”生产NO,反应原理为$aNH_{3} + bO_{2}\xlongequal{催化剂}cNO + dX$。兴趣小组模拟生产NO,在一密闭容器中充入一定量的$NH_{3}和O_{2}$充分反应,反应中部分物质的质量随反应过程的变化如图所示。下列说法错误的是( )。
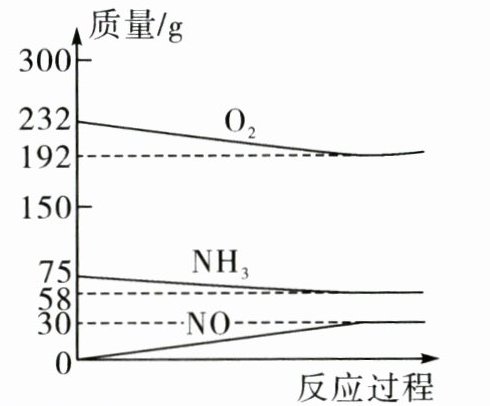
A.X为$H_{2}O_{2}$
B.化学计量数$a = 4$
C.化学方程式中b与c的比为$5:4$
D.充分反应后,生成X的质量为27g

A.X为$H_{2}O_{2}$
B.化学计量数$a = 4$
C.化学方程式中b与c的比为$5:4$
D.充分反应后,生成X的质量为27g
答案:
A [解析]由图像可知,参加反应的氨气的质量为75g-58g=17g,参加反应的氧气的质量为232g-192g=40g,而生成的一氧化氮的质量为30g,则生成X的质量为17g+40g-30g=27g,又由于17g氨气中氢元素的质量为17g×$\frac{1×3}{1×3+14}$×100%=3g,氮元素的质量为17g-3g=14g,30g一氧化氮中氮元素的质量为30g×$\frac{14}{14+16}$×100%=14g,根据反应前后元素种类和质量不变,可知X中氢元素的质量为3g,且不含氮元素,则含氧元素的质量为27g-3g=24g,氢、氧原子个数比为$\frac{3\;g}{1}$:$\frac{24\;g}{16}$=2:1,即X的化学式为H₂O,A错误;根据反应前后原子种类和数目不变,再结合X为H₂O,反应的化学方程式为4NH₃+5O₂$\frac{\underline{催化剂}}{}$4NO+6H₂O,则a=4,B正确;结合分析可知,b与c的比为5:4,C正确;结合分析可知,充分反应后,生成X的质量为27g,D正确。
查看更多完整答案,请扫码查看


