4. “中和反应”实验中,下列使用胶头滴管的操作正确的是 ( )
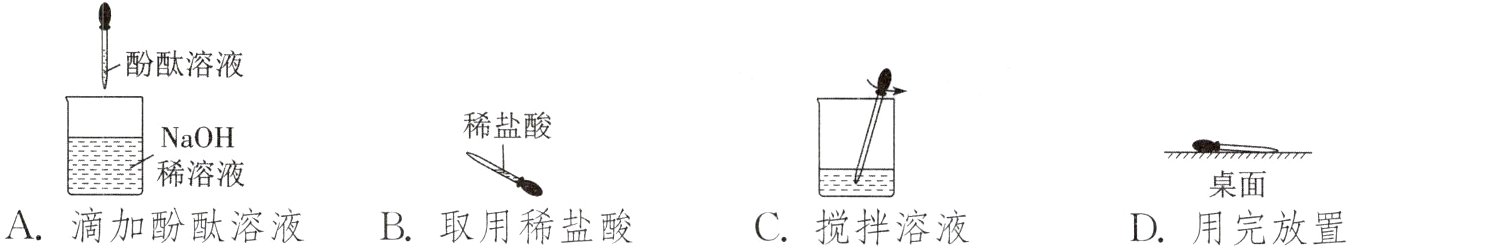

答案:
A
5. (2023·眉山)四种食物的近似pH如表所示,你认为胃酸过多的患者不宜多吃的食物是 ( )

A. 苹果汁
B. 豆浆
C. 玉米粥
D. 鸡蛋清

A. 苹果汁
B. 豆浆
C. 玉米粥
D. 鸡蛋清
答案:
A
6. (2024·无锡一模)如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是 ( )
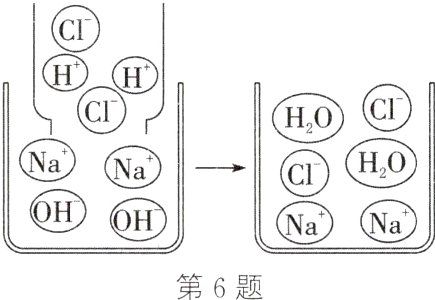
A. 该反应的实质是$Na^{+}$和$Cl^{-}$结合生成食盐分子
B. 反应前后离子的总数不变
C. 反应后溶液中的粒子只有$Na^{+}$和$Cl^{-}$
D. 反应前后$Na^{+}$和$Cl^{-}$的总数不变

A. 该反应的实质是$Na^{+}$和$Cl^{-}$结合生成食盐分子
B. 反应前后离子的总数不变
C. 反应后溶液中的粒子只有$Na^{+}$和$Cl^{-}$
D. 反应前后$Na^{+}$和$Cl^{-}$的总数不变
答案:
D
7. 从氯碱工业产生的盐泥中回收$BaSO_{4}$,其主要工艺流程如图所示。[已知:① 盐泥的主要成分为$BaSO_{4}$、$NaCl$、$Mg(OH)_{2}$和$CaCO_{3}$;② $BaSO_{4}$难溶于水,不与盐酸反应]

(1)除去$NaCl$利用的性质是____________________________。
(2)酸溶槽中发生中和反应的化学方程式为____________________________。
(3)过滤器中分离出来的固体是________。

(1)除去$NaCl$利用的性质是____________________________。
(2)酸溶槽中发生中和反应的化学方程式为____________________________。
(3)过滤器中分离出来的固体是________。
答案:
(1)$NaCl$易溶于水
(2)$Mg(OH)_{2} + 2HCl = MgCl_{2} + 2H_{2}O$
(3)$BaSO_{4}$
(1)$NaCl$易溶于水
(2)$Mg(OH)_{2} + 2HCl = MgCl_{2} + 2H_{2}O$
(3)$BaSO_{4}$
8. (2023·恩施)化学课外活动小组同学为测定实验室中一瓶失去标签的稀盐酸的溶质质量分数。取该稀盐酸50 g,向其中逐滴滴加溶质质量分数为8%的氢氧化钠溶液,同时测得其pH与加入氢氧化钠溶液质量的关系如图所示。
(1)图中a点时所得溶液中的溶质为________(填化学式)。
(2)请你计算该瓶稀盐酸的溶质质量分数。
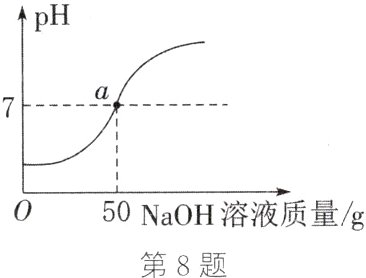
(1)图中a点时所得溶液中的溶质为________(填化学式)。
(2)请你计算该瓶稀盐酸的溶质质量分数。

答案:
(1)$NaCl$
(2)解:恰好完全反应时消耗氢氧化钠溶液的质量为50g,其中溶质的质量为$50g×8\% = 4g$。设该瓶稀盐酸的溶质质量分数为$x$。
$HCl + NaOH = NaCl + H_{2}O$
36.5 40
$50g×x$ 4g
$\frac{36.5}{40} = \frac{50g×x}{4g}$ $x = 7.3\%$
答:该瓶稀盐酸的溶质质量分数为7.3%。
解析:
(1)稀盐酸与氢氧化钠反应生成氯化钠和水,由图可知,图中$a$点时溶液的$pH = 7$,说明此时稀盐酸与氢氧化钠恰好完全反应,则所得溶液中溶质为生成的氯化钠,其化学式为$NaCl$。
(1)$NaCl$
(2)解:恰好完全反应时消耗氢氧化钠溶液的质量为50g,其中溶质的质量为$50g×8\% = 4g$。设该瓶稀盐酸的溶质质量分数为$x$。
$HCl + NaOH = NaCl + H_{2}O$
36.5 40
$50g×x$ 4g
$\frac{36.5}{40} = \frac{50g×x}{4g}$ $x = 7.3\%$
答:该瓶稀盐酸的溶质质量分数为7.3%。
解析:
(1)稀盐酸与氢氧化钠反应生成氯化钠和水,由图可知,图中$a$点时溶液的$pH = 7$,说明此时稀盐酸与氢氧化钠恰好完全反应,则所得溶液中溶质为生成的氯化钠,其化学式为$NaCl$。
查看更多完整答案,请扫码查看


