11. 某小组利用如图所示的装置(装置气密性良好)进行实验。实验时先观察一段时间,发现无明显现象,然后用胶头滴管向装置中加入氯化钠溶液,8 min后打开弹簧夹,发现注射器活塞向左移动。下列说法不合理的是 ( )

A. 铁的锈蚀是氧化反应
B. 使用氯化钠溶液的目的是加快铁的锈蚀
C. 此实验能推断出铁的锈蚀需要水的参与
D. 此实验能测出空气中氧气含量

A. 铁的锈蚀是氧化反应
B. 使用氯化钠溶液的目的是加快铁的锈蚀
C. 此实验能推断出铁的锈蚀需要水的参与
D. 此实验能测出空气中氧气含量
答案:
C
12. 已知A、B、C三种物质的溶解度曲线如图所示,现将x g A、y g B、z g C分别在10 ℃、20 ℃、30 ℃时加入100 g水中,对应的点分别为a、b、c三点。下列分析正确的是 ( )

A. a、b、c三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c点恰好形成无色的饱和溶液
D. 升温至30 ℃时,三种溶液的溶质质量分数的大小关系为A=C>B

A. a、b、c三点表示的溶液均为饱和溶液
B. 三种溶液中溶质质量分数最大的是A
C. c点恰好形成无色的饱和溶液
D. 升温至30 ℃时,三种溶液的溶质质量分数的大小关系为A=C>B
答案:
D 解析:溶解度曲线上的点对应的溶液为该物质的饱和溶液,溶解度曲线上方的点对应的溶液为该物质的饱和溶液且有未溶解的物质,溶解度曲线下方的点对应的溶液为该物质的不饱和溶液,b点在B物质溶解度曲线的下方,表示不饱和溶液,A错误。观察三种物质的溶解度曲线可知,10℃时xgA不能完全溶解于100g水中,20℃时ygB能完全溶解于100g水中,30℃时zgC恰好能完全溶解于100g水中,由题图可知,100g水中溶解的A、B、C的质量大小关系为C>A>B,则三种溶液中溶质质量分数最大的是C,B错误。c点表示30℃时100g水中恰好能溶解zgC物质达到饱和,则c点恰好能形成饱和溶液,但不能确定该溶液是否无色,C错误。升温至30℃时,A、B、C三种物质都能全部溶解,溶解的A、B、C的质量分别为xg、yg、zg,由题图可知,x = z>y,溶剂质量均为100g,所得三种溶液的溶质质量分数的大小关系为A = C>B,D正确。
13. 科学的进步源于发现问题、解决问题,请思考下列实验方案中,不能达到实验目的的是 ( )
|选项|实验目的|实验方案|
|----|----|----|
|A|鉴别$CO_{2}$和$O_{2}$|将带火星的木条伸入集气瓶中|
|B|鉴别$NaOH$和$NH_{4}NO_{3}$固体|取样,分别加水溶解|
|C|除去$KCl$固体中少量的$MnO_{2}$|加水溶解、过滤、洗涤、干燥|
|D|除去$FeSO_{4}$溶液中少量的$CuSO_{4}$|加入过量铁粉,过滤|
|选项|实验目的|实验方案|
|----|----|----|
|A|鉴别$CO_{2}$和$O_{2}$|将带火星的木条伸入集气瓶中|
|B|鉴别$NaOH$和$NH_{4}NO_{3}$固体|取样,分别加水溶解|
|C|除去$KCl$固体中少量的$MnO_{2}$|加水溶解、过滤、洗涤、干燥|
|D|除去$FeSO_{4}$溶液中少量的$CuSO_{4}$|加入过量铁粉,过滤|
答案:
C
14. 向盛有一定质量$MgSO_{4}$、$FeSO_{4}$和$CuSO_{4}$混合溶液的烧杯中加入锌粉至过量,使其充分反应(溶液始终未饱和),烧杯中溶质、溶剂、金属的质量随加入锌粉的质量的变化情况如图所示。下列说法不正确的是 ( )
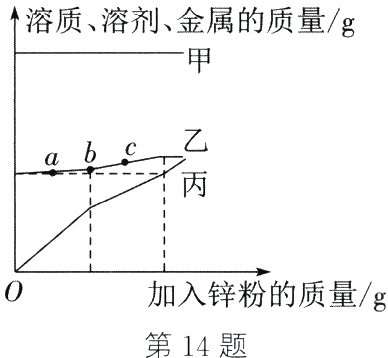
A. 丙代表烧杯中金属的质量
B. ab段发生反应:$Zn + CuSO_{4} = ZnSO_{4} + Cu$
C. 溶液的质量:a>c
D. c点溶液一定呈浅绿色

A. 丙代表烧杯中金属的质量
B. ab段发生反应:$Zn + CuSO_{4} = ZnSO_{4} + Cu$
C. 溶液的质量:a>c
D. c点溶液一定呈浅绿色
答案:
C 解析:由金属活动性:Mg>Zn>Fe>Cu可知,向盛有一定质量MgSO₄、FeSO₄和CuSO₄混合溶液的烧杯中加入锌粉至过量,锌不与MgSO₄反应,锌先与CuSO₄反应生成硫酸锌和铜,待CuSO₄反应完全后,锌才能与FeSO₄反应生成硫酸锌和铁。反应前,烧杯中没有金属,开始反应后,烧杯中金属的质量逐渐增大,故丙代表烧杯中金属的质量,A选项说法正确。由上述分析可知,ab段发生反应的化学方程式为Zn + CuSO₄ = ZnSO₄ + Cu,B选项说法正确。a点处发生反应的化学方程式及质量关系为Zn + CuSO₄ = ZnSO₄ + Cu,由此可知每65份质量的锌可置换出64份质量的铜,溶液的质量会增加;c点处发生反应的化学方程式及质量关系为Zn + FeSO₄ = ZnSO₄ + Fe,由此可知每65份质量的锌可置换出56份质量的铁,溶液的质量会增加;因此溶液的质量一直是增加的,故溶液的质量:a<c,C选项说法错误。c点时硫酸亚铁还没有完全反应,故溶液呈浅绿色,D选项说法正确。
15. 现有$Mg$和$MgO$的固体混合物3 g,经测定镁元素的质量分数为80%,向固体混合物中加入100 g一定溶质质量分数的稀硫酸,恰好完全反应(已知:$MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$),下列说法不正确的是 ( )
A. 反应后溶液中的溶质只有$MgSO_{4}$
B. 反应中有气泡产生
C. 所用稀硫酸中溶质的质量分数为19.6%
D. 生成$MgSO_{4}$的质量为12 g
A. 反应后溶液中的溶质只有$MgSO_{4}$
B. 反应中有气泡产生
C. 所用稀硫酸中溶质的质量分数为19.6%
D. 生成$MgSO_{4}$的质量为12 g
答案:
C 解析:镁与稀硫酸反应生成硫酸镁和氢气,氧化镁与硫酸反应生成硫酸镁和水,所以Mg和MgO的固体混合物与硫酸恰好完全反应后溶液中的溶质只有硫酸镁,A正确;由于固体混合物中含有金属镁,金属镁与稀硫酸反应生成氢气,故反应过程中有气泡产生,B正确;固体混合物中镁元素的质量为3g×80% = 2.4g,反应后镁元素全部转化为MgSO₄,所以反应后生成MgSO₄的质量为$\frac{2.4g}{\frac{24}{24 + 32 + 16×4}×100\%}$ = 12g,D正确;根据发生反应的化学方程式可知稀硫酸与硫酸镁的关系式为H₂SO₄~MgSO₄;设稀硫酸中溶质的质量分数为x。
H₂SO₄ ~ MgSO₄
98 120
100g×x 12g
$\frac{98}{120}$ = $\frac{100g×x}{12g}$ x = 9.8%
C错误。
H₂SO₄ ~ MgSO₄
98 120
100g×x 12g
$\frac{98}{120}$ = $\frac{100g×x}{12g}$ x = 9.8%
C错误。
查看更多完整答案,请扫码查看


