【题目】某化学兴趣小组为测定铜与浓硫酸反应后残余清液中硫酸的溶质质量分数,提出了下列实验方案:
【查阅资料】Cu+2H2SO4(浓) Cu SO4+ SO2↑+2H2O
【实验设计】甲方案:将残余清液与足量BaCl2溶液反应,称量生成的BaSO4质量。
乙方案:将残余清液与足量锌粒反应,测量生成氢气的体积。
【分析交流】
(1)铜与浓硫酸反应中即使铜过量也不能将硫酸完全反应的原因是__________;
(2)甲方案是否可行?_________(填“可行”或“不可行”),理由是_________;
【实验探究】
(3)小王同学选用图2中的部分实验装置进行了乙方案的实验:
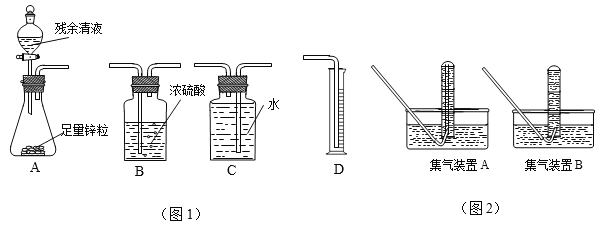
①你认为图1中最简易的装置及其连接顺序是:__________;
② 实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后残余清液
就不能顺利滴入锥形瓶。其原因是________;
③ 某学生想用排水法收集氢气并检验其纯度,应选择图2中的集气装置________(填“A”或“B”)。
(4)小张同学用如图3所示装置进行了乙方案的实验:
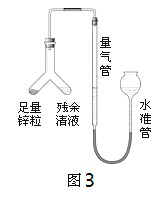
① 连接仪器,检查此装置气密性。下列能说明装置气密性良好的是________(填序号);
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平。
② 实验中残余清液与锌粒混合后的现象是锌粒逐渐溶解、_____、产生大量气泡,放出热量。
反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐渐减小的原因是___(排除仪器和实验操作的影响因素)。
④ 若实验中测得残余清液中硫酸的溶质质量分数偏大,下列可能的原因是________。
a.装置漏气
b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
参考答案:
【答案】 随着反应的进行,浓硫酸浓度下降变成稀硫酸,铜与稀硫酸不反应 不可行 加入足量BaCl2溶液只能求出SO42—质量,不能求出剩余硫酸的浓度(或残余清液中有CuSO4、或BaCl2与CuSO4、H2SO4均反应) ACD 反应产生大量气体,使瓶中压强增大 B A 锌表面析出红色固体或溶液由蓝色变成无色等 反应放热,气体在冷却过程中体积逐渐减少 c
【解析】【分析交流】
(1)根据金属活动性顺序的应用,只有位于氢前面的金属才能与稀盐酸或稀硫酸反应。随着反应的进行,浓硫酸浓度下降变成稀硫酸,而铜与稀硫酸不反应;(2)由于生成物中含有的硫酸铜也能与氯化钡反应生成硫酸钡沉淀,故该方案不可行;(3)①乙方案是将残余清液与足量锌粒反应,测量生成氢气的体积,要测定生成的氢气的体积可用排水法通过测定排出的水的体积来判断生成氢气的体积,故连接顺序是ACD;②锌与稀硫酸反应生成氢气,会导致锥形瓶中的压强变大,故过一会儿后残余清液就不能顺利滴入锥形瓶;③用排水法收集氢气,导气管要放在试管口,否则会导致水不能排尽,故选B;(4)①检查此装置气密性的方法是:连接仪器后,向水准管中注水,若左右两边管内能形成稳定高度差,说明装置的气密性良好,故选A;②实验中残余清液中除了含有硫酸外,还含有硫酸铜,故加入锌粒,观察到的现象是:开始时锌粒逐渐的溶解,产生大量的气泡,一定时间后无气泡产生,锌的表面覆盖一层红色的物质,溶液由蓝色变成无色;③锌与稀硫酸反应放热,反应完毕后,温度逐渐降低,故气体的体积逐渐的减少直至不变;④a、若装置漏气则收集不到氢气,那么会导致硫酸的溶质质量分数偏小;b、读取数据时水准管的水面高于量气管的水面,即会导致测定的氢气的体积偏小,那么硫酸的溶质质量分数偏小;c、未待冷却就读取量气管读数会导致氢气的体积变大,那么硫酸的溶质质量分数会偏大。故选c。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钠放置在空气中变质的原因是________(用化学方程式表示)
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,生活中蕴藏着丰富的化学知识.
(1)目前,人类以化石燃料为主要能源,化石燃料有煤、_________和天然气。
(2)液态二氧化碳灭火器可用于扑灭档案室发生的火灾,下列说法正确的_________(填序号)。
A.液态二氧化碳气化后不会污染档案资料
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物着火点
(3)氯化钠(NaCl) 和硝酸钾 (KNO3) 在不同温度时的溶解度及其溶解度曲线如下:

图中能表示KNO3溶解度曲线的是________(填“甲”或“乙”)。
t1oC时,等质量的甲和乙二种物质分别加水制成相应的饱和溶液,得到溶液质量较大的是________ 。(填“甲”或“乙”)
③20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g水,充分溶解后,恢复至20℃,其结果如图所示。下列有关说法中,正确的有________。(填字母编号)

A.烧杯①中溶解的是KNO3,烧杯②中溶解的是NaCl
B.烧杯②中溶液一定是不饱和溶液
C.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
D.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
(4)亚硝酸钠(NaNO2)是一种常用的防腐剂。结合下图“小资料”回答问题:

①根据资料,小明设计如图的实验:
实验A中观察到的现象是________,反应的化学方程式为________,实验B观察到溶液最终变为_______色。
②亚硝酸钠加热分解放出有刺激性气味的气体,该气体可能是________(填字母)。
A.NO2 B.NH3 C.N2 D.SO2.
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图,回答有关问题:
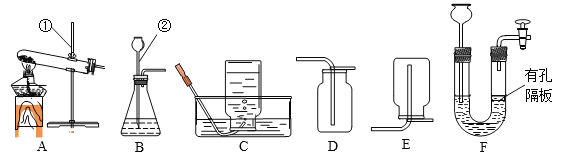
(1)写出有标号的仪器名称:①________,②________。
(2)实验室要制得干燥的O2,选择的实验制取装置是______,反应的化学方程式为________。
(3)实验室制取CO2,的化学方程式为______,利用该装置也可制备_______ 气体。
(4)现配制100g质量分数为7.3%的稀盐酸,若量取浓盐酸时俯视读数,则所配制的稀盐酸的质量分数将_______(填“偏大”、“偏小”)。将准确配制的上述稀盐酸全部加入盛有20g的石灰石样品的烧杯中,恰好能与石灰石样品中的碳酸钙完全反应(杂质不与稀盐酸反应),
则该石灰石样品中碳酸钙的质量分数是多少?(写出计算过程)____
-
科目: 来源: 题型:
查看答案和解析>>【题目】无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去。请写出:
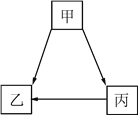
(1)若反应皆为化合反应,且均在点燃条件下发生,则丙的化学式为____________;
(2)若反应皆为复分解反应,乙为白色难溶物。且甲为常见的酸,甲、乙、丙含相同的原子团,丙溶液为蓝色溶液,则丙生成乙的化学方程式为_________________________(写一个)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填写下列内容:
(1)碳酸根离子_______________。
(2)用下列四种元素(O.H .Ca. Cl)写化学式:酸________、碱_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展做出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工艺流程大致如下图所示:

(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、___________等;
(2)上述流程中,可循环利用的物质是_____________;
(3)上述流程中,“一种氮肥”的化学式是____________。
相关试题

