【题目】某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁的实验进行了绿化改进后制取单质铁(K1、K2是活塞)。
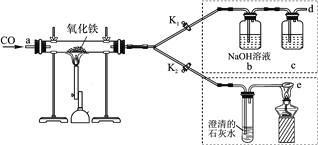
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行____________;
②CO还原Fe2O3的化学方程式为________________________________;
③在e处点燃气体的目的是________________。
(2)关闭K2、开启K1,可以将d口出来的气体再从a通入装置而循环使用。
①c瓶中应装________(填字母序号)。
A.澄清石灰水 B.水
C.石蕊溶液 D.浓硫酸
②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶溶液中得到纯碱固体,必要的实验操作为转移、________、结晶。
③该实验这样改进的主要优点是__________________________________________。
参考答案:
【答案】 气密性检查 3CO+Fe2O3![]() 2Fe+3CO2 防止污染空气 D 蒸发 减少一氧化碳的排放,提高原料利用率
2Fe+3CO2 防止污染空气 D 蒸发 减少一氧化碳的排放,提高原料利用率
【解析】(1)①关于气体的实验,实验前必须检查装置的气密性;②CO还原Fe2O3,是一氧化碳和氧化铁高温下反应生成铁的二氧化碳,的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2;③尾气中有未反应的一氧化碳,是空气污染物,在e处点燃气体的目的是点燃尾气中的一氧化碳,防止污染空气;(2)①c瓶中应装浓硫酸,将一氧化碳进行干燥处理,②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶溶液中得到纯碱固体,必要的实验操作为转移,然后进行蒸发结晶,使可溶的碳酸钠与溶剂水分离。③该实验这样改进避免的尾气对空气可能造成的污染、将一氧化碳燃烧,利用其释放的热量,可以节约能源。
2Fe+3CO2;③尾气中有未反应的一氧化碳,是空气污染物,在e处点燃气体的目的是点燃尾气中的一氧化碳,防止污染空气;(2)①c瓶中应装浓硫酸,将一氧化碳进行干燥处理,②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶溶液中得到纯碱固体,必要的实验操作为转移,然后进行蒸发结晶,使可溶的碳酸钠与溶剂水分离。③该实验这样改进避免的尾气对空气可能造成的污染、将一氧化碳燃烧,利用其释放的热量,可以节约能源。
-
科目: 来源: 题型:
查看答案和解析>>【题目】银制容器在中放置一段时间后表面会变黑,原因是银和空气中的微量硫化物等物质发生反应,其化学反应方程式为4Ag+2H2S+O2═2X+2H2O,则X的化学式为
A.AgS B.Ag2O C.Ag2S D.Ag2O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】用过氧化氢溶液制取O2时,忘记加入MnO2了,其结果是( )
A. 放出的O2总量会减少 B. 不放出O2
C. 放出O2的总量会减少且速率变慢 D. 放出O2的速率变慢
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】
1.草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O43H2O
 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
3.铁的常见氧化物中铁的质量分数:
铁的氧化物
FeO
Fe2O3
Fe3O4
铁的质量分数
77.8%
70.0%
72.4%
【问题讨论】为了测定铁红中铁的质量分数,小组间学进行如下实验。(装置气密性良好)

(1) 该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是 (填字母序号)
A.浓硫酸 B.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 。
(3)写出E装置中所发生反应的一个化学方程式: 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 。
【实验反思】
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组利用下图装置进行实验。探究工业炼铁的化学原理,试按要求填空。

(1)硬质玻璃管中观察到的现象是__________,写出一氧化碳和氧化铁反应的化学方程式________;
(2)实验中首先通入一氧化碳的目的是__________;
(3)装置中导管末端加一点燃的酒精灯目的是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】 “水是生命的源泉”.下面对水化学式(H2O)意义的理解,错误的是
A.水是一种氧化物
B.水是由氢、氧两种元素组成的
C.水分子中含有氢、氧两种原子
D.水分子中含有两个氢原子、一个氧原子
-
科目: 来源: 题型:
查看答案和解析>>【题目】日常生活中经常接触到“含氟牙膏”、“高钙牛奶”、“加碘食盐”、“加铁酱油”等用品,这里的氟、钙、碘、铁是指 ( )
A. 分子 B. 原子 C. 离子 D. 元素
相关试题

