【题目】化学小组对蜡烛的燃烧过程进行了再一次探究。
【查阅资料】硫酸铜(CuSO4)是一种白色粉末,具有吸水性,吸水后变为蓝色。该物质中铜、硫、氧三种元素的质量之比为__________。
【进行实验】
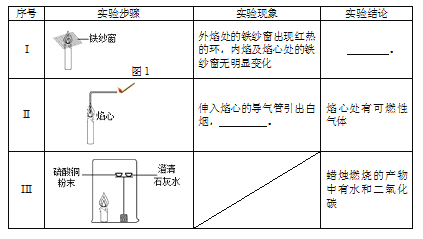
(1)实验I得到的结论是________。
(2)补全实验II的实验现象:_________。
(3)实验III中,硫酸铜粉末的作用是___________;得到“蜡烛燃烧的产物中含有二氧化碳”这一结论所对应的实验现象是___________。
【反思与评价】
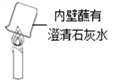
(4)实验III是该小组同学对如下图所示实验的改进。与下图所示实验相比,实验III的优点是__________。
参考答案:
【答案】 2:1:2 蜡烛火焰外焰的温度高于内焰及焰心处温度 白烟燃烧(或白烟被点燃) 检验蜡烛燃烧是否有水生成 澄清石灰水变浑浊 能够同时检验是否有水和二氧化碳生成
【解析】【查阅资料】硫酸铜铜、硫、氧三种元素的质量之比为![]() ;【进行实验】(1)由实验现象:外焰处的铁纱窗出现红热的环,内焰及焰心处的铁纱窗无明显变化,说明蜡烛火焰外焰的温度高于内焰及焰心处温度;(2)伸入焰心的导气管引出白烟,白烟燃烧,说明焰心处有可燃性物质;(3)实验Ⅲ中,硫酸铜粉末的作用是检验蜡烛燃烧是否有水生成,得到“蜡烛燃烧的产物中含有二氧化碳”这一结论所对应的实验现象是澄清石灰水变浑浊;【反思与评价】实验Ⅲ是下图实验相比,实验Ⅲ的优点是能够同时检验是否有水和二氧化碳生成。
;【进行实验】(1)由实验现象:外焰处的铁纱窗出现红热的环,内焰及焰心处的铁纱窗无明显变化,说明蜡烛火焰外焰的温度高于内焰及焰心处温度;(2)伸入焰心的导气管引出白烟,白烟燃烧,说明焰心处有可燃性物质;(3)实验Ⅲ中,硫酸铜粉末的作用是检验蜡烛燃烧是否有水生成,得到“蜡烛燃烧的产物中含有二氧化碳”这一结论所对应的实验现象是澄清石灰水变浑浊;【反思与评价】实验Ⅲ是下图实验相比,实验Ⅲ的优点是能够同时检验是否有水和二氧化碳生成。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图1中A~E是初中化学中常见的物质。D、E 均为只含两种元素的化合物。通常情况下,D为无色液体,其他均为无色气体。拉瓦锡的研究认为空气由B、C组成。在高温和铁的催化作用下,E转化为A和C。E的分子示意图如图2所示。图1中“
 ”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。 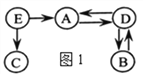
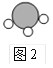
(1)写出化学式:B_________,D_________。
(2)C有许多用途,请写出一种_______________。
(3)写出E转化为A和C的化学方程式__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用高锰酸钾和A图装置制取氧气,并进行氧气性质实验。

(1)仪器①的名称是________,仪器②的名称是________。
(2)反应的化学方程式为_______________。
(3)A图装置中收集氧气的方法为________。实验室还可以用上图中的________(填字母序号)所示方法收集氧气,原因是________。
(4)实验结束时,若先停止加热则会导致水到吸,损坏仪器,引起倒吸的原因是________。
(5)D图为木炭在空气和氧气中燃烧的对比实验。实验结论:________,木炭燃烧越剧烈。
(6)写出铁丝在氧气中燃烧的化学方程式_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)18世纪末,人们就开始了对水的组成的研究。
①英国科学家普利斯特里把“易燃空气”(氢气)和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时发出震耳的爆鸣声,且玻璃瓶内壁上出现了液滴。不久,卡文迪许用纯氧代替空气进行上述实验,确认所得液滴是水,该反应的化学方程式是__________________________。
②基于卡文迪许实验,可得出的关于水的组成的结论是__________。
A.水是由氢气和氧气组成的
B.水是由氢元素和氧元素组成的
C.每个水分子是由2个氢原子和l个氧原子构成的
③后来,科学家进一步利用电解水实验(如下图所示)证明水的组成,实验中得到氧气的试管是________(填“1” 或“2”)。
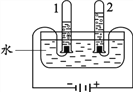
(2)固城湖水为软水,井水为硬水。
①要除去固城湖水及井水水样中的不溶物,可采取的操作是________。
②完成该操作后,验证所得水样属于硬水还是软水,可用的物质是________。
③生活中可使用__________的方法降低井水的硬度。
(3)净化水时,常用到活性炭。右图所示装置中活性炭可达到的目的有______。
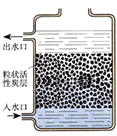
A.除去泥沙 B.除去可溶性钙镁化合物
C.除去臭味 D.使海水变为淡水
(4)下列做法有利于保护水资源的是______。
A.抑制水中所有动、植物的生长 B.为了节约,直接用工业污水灌溉农田
C.洗菜的水用来浇花 D.生活污水集中处理达标后排放
-
科目: 来源: 题型:
查看答案和解析>>【题目】某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C表示如下:
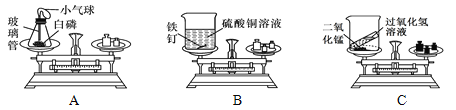
A、B、C三个实验分别由甲、乙、丙三个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
(1)A实验:锥形瓶底放层细沙的原因是________________。引燃白磷待反应结束,锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。反应的化学方程式为_______________。实验过程中小气球的变化是________。
(2)乙组同学认为B实验验证了质量守恒定律。此处化学反应的现象是_______________。请结合该反应表述质量守恒定律_______________。
(3)丙组同学得到的错误结论是“C实验说明质量不守恒”。你认为C实验天平不平衡的原因是_______。该反应的化学方程式为_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组通过实验探究分解氯酸钾制氧气的反应中二氧化锰的作用,该反应的化学方程式为______________________________。
【设计实验】用图1所示装置进行实验, 步骤如下:
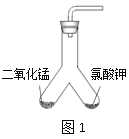
步骤Ⅰ:__________________;
步骤Ⅱ:装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
【实验现象】步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是_____________。
【交流反思】要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的______________和____________在反应前后都没有发生变化。
【拓展探究】在老师的指导下,该小组同学利用图2所示装置继续进行深入探究。以氧气的体积分数为纵坐标,温度为横坐标,得到图3 所示曲线(图中的“1︰2”、“1︰1”、“2︰1”、“3︰1”、“4︰1”、“5︰1”指氯酸钾和二氧化锰的质量比)。
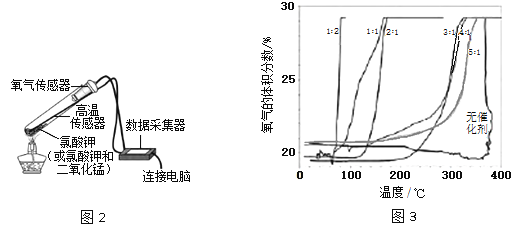
【实验分析】根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是__________________;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能_________________。
【交流应用】将29.4g氯酸钾和二氧化锰的混合物(氯酸钾和二氧化锰的质量比为5︰1)加热至完全反应,剩余固体的质量为___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A~I是初中化学常见的物质。常温常压下,A、B为液体,F为红色固体,H为有刺激性气味的气体;E在C中剧烈燃烧时,火星四射,生成黑色固体。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
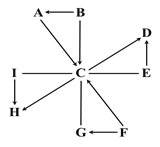
(1)单质I在纯净的C中燃烧,发出__________色火焰,该反应属于___________(写基本反应类型)。
(2)写出化学方程式:
A转化为C的反应_______________________________。
C与E发生的反应______________________________。
C与G发生的反应______________________________。
相关试题

