【题目】图中A~I是初中化学常见的物质。常温常压下,A、B为液体,F为红色固体,H为有刺激性气味的气体;E在C中剧烈燃烧时,火星四射,生成黑色固体。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
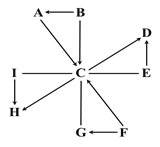
(1)单质I在纯净的C中燃烧,发出__________色火焰,该反应属于___________(写基本反应类型)。
(2)写出化学方程式:
A转化为C的反应_______________________________。
C与E发生的反应______________________________。
C与G发生的反应______________________________。
参考答案:
【答案】 蓝紫 化合反应 2H2O![]() 2H2↑+O2↑ 3Fe+2O2
2H2↑+O2↑ 3Fe+2O2 ![]() Fe3O4 2Hg+O2
Fe3O4 2Hg+O2![]() 2HgO
2HgO
【解析】常温常压下,A、B为液体,F为红色固体,H为有刺激性气味的气体;E在C中剧烈燃烧时,火星四射,生成黑色固体。A是过氧化氢B是水C是氧气D是四氧化三铁E是铁F是氧化汞G是汞I是硫H是二氧化硫。(1)单质I是硫在纯净的C是氧气中燃烧,发出蓝紫色火焰,该反应属于化合反应,两种物质生成了一种物质。(2)化学方程式:A转化为C的反应∶2H2O![]() 2H2↑+O2↑。C与E发生的反应∶3Fe+2O2
2H2↑+O2↑。C与E发生的反应∶3Fe+2O2 ![]() Fe3O4。C与G发生的反应∶2Hg+O2
Fe3O4。C与G发生的反应∶2Hg+O2![]() 2HgO
2HgO
点睛∶掌握常见物质的性质是对学生的基本要求,也是中考必考的知识点。2Hg+O2![]() 2HgO,2HgO
2HgO,2HgO ![]() 2Hg+O2↑。
2Hg+O2↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学小组对蜡烛的燃烧过程进行了再一次探究。
【查阅资料】硫酸铜(CuSO4)是一种白色粉末,具有吸水性,吸水后变为蓝色。该物质中铜、硫、氧三种元素的质量之比为__________。
【进行实验】
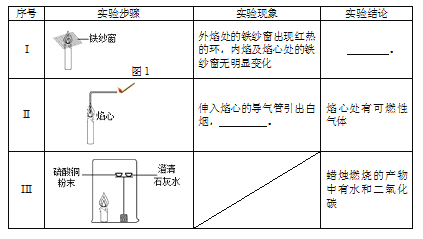
(1)实验I得到的结论是________。
(2)补全实验II的实验现象:_________。
(3)实验III中,硫酸铜粉末的作用是___________;得到“蜡烛燃烧的产物中含有二氧化碳”这一结论所对应的实验现象是___________。
【反思与评价】
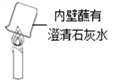
(4)实验III是该小组同学对如下图所示实验的改进。与下图所示实验相比,实验III的优点是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C表示如下:
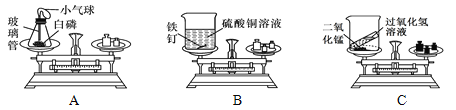
A、B、C三个实验分别由甲、乙、丙三个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
(1)A实验:锥形瓶底放层细沙的原因是________________。引燃白磷待反应结束,锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。反应的化学方程式为_______________。实验过程中小气球的变化是________。
(2)乙组同学认为B实验验证了质量守恒定律。此处化学反应的现象是_______________。请结合该反应表述质量守恒定律_______________。
(3)丙组同学得到的错误结论是“C实验说明质量不守恒”。你认为C实验天平不平衡的原因是_______。该反应的化学方程式为_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组通过实验探究分解氯酸钾制氧气的反应中二氧化锰的作用,该反应的化学方程式为______________________________。
【设计实验】用图1所示装置进行实验, 步骤如下:
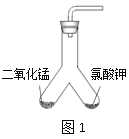
步骤Ⅰ:__________________;
步骤Ⅱ:装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
【实验现象】步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是_____________。
【交流反思】要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的______________和____________在反应前后都没有发生变化。
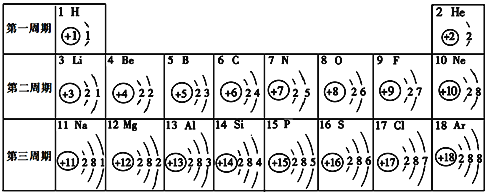
【拓展探究】在老师的指导下,该小组同学利用图2所示装置继续进行深入探究。以氧气的体积分数为纵坐标,温度为横坐标,得到图3 所示曲线(图中的“1︰2”、“1︰1”、“2︰1”、“3︰1”、“4︰1”、“5︰1”指氯酸钾和二氧化锰的质量比)。
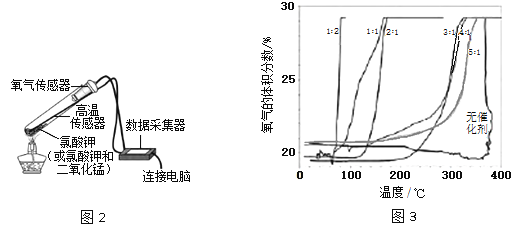
【实验分析】根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是__________________;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能_________________。
【交流应用】将29.4g氯酸钾和二氧化锰的混合物(氯酸钾和二氧化锰的质量比为5︰1)加热至完全反应,剩余固体的质量为___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,回答有关问题:
(1)第三周期中的金属元素有___________________(填元素名称)。
(2)写出硫离子的化学符号_________________。
(3)钾在元素周期表中位于第四周期,且在钠的正下方,钾原子的结构特点是_______________。
(4)利用上表中给出的元素,写出含有氮元素的常见物质的化学式各一个:
单质________、化合物________(氮的化合价是+4)、化合物________(氮的化合价是-3)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是在分子、原子层次上研究物质性质、组成、结构与变化规律的科学。
(1)用化学符号填空:
①两个氢原子_________________; ②氩气_________________;
③保持氧气化学性质的最小粒子_________________;
④地壳中含量最多的金属元素_________________;
⑤写出氧化铁的化学式,并标出铁元素的化合价_________________。
(2)有六种物质:A.高锰酸钾,B.氧化镁,C.空气,D.铁,E.水,F.氯化钠。用字母填空:
①属于混合物的是___________; ②属于单质的是___________;
③属于化合物的是__________; ④属于氧化物的是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图,回答有关问题:
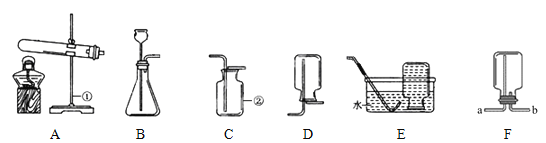
(1)写出装置图中标号仪器的名称:①_________,②_________。
(2)在实验室里通过分解过氧化氢制氧气,选择的发生装置是_______(填字母),化学方程式是___________________________。
(3)某气体可用装置D收集,若改用装置F收集,该气体应从____口通入(填“a”或“b”)。
(4)加热分解15.8 g高锰酸钾,可以得到氧气的质量是______?(利用化学方程式进行计算,写出计算过程)
相关试题

