【题目】有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种。为确定其组成,取少量固体加足量水溶解得到无色溶液M,进行下图实验。

试推断:
(1)白色沉淀B是______ (填化学式)。
(2)原固体中一定含有的物质是_______。
(3)无色滤液2中一定含有的阳离子是__________(填离子符号)。
(4)通过上述实验可知还有一种物质不能确定是否存在,为进一步确定,应采用的方法是____。
参考答案:
【答案】 AgCl NaOH、Na2SO4 Na+、H+、Ba2+ 方法一:将上述实验中的稀盐酸改成稀硝酸
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl
【解析】(1)混合溶液加入酚酞后变为红色,说明该溶液显碱性,加入过量的稀盐酸无气泡产生,说明溶液中没有碳酸盐,故溶液中一定有氢氧化钠,少量固体加足量水溶解得到无色溶液M,说明原混合物中没有氯化镁,无色的溶液中加入过量的硝酸钡,有白色的沉淀生成,说明溶液中有硫酸钠,再加入硝酸银有白色的沉淀B生成,说明白色沉淀B是氯化银,故化学式为AgCl;
(2)由上分析,溶液中一定有硫酸钠和氢氧化钠,最后加入硝酸银有白色沉淀生成,可能是加入稀盐酸时带入的氯离子与硝酸银反应生成沉淀,故不能确定有氯化钠,故该混合物中一定含有的物质是氢氧化钠和硫酸钠;
(3)原物质中加入稀盐酸后,氢氧化钠与稀盐酸反应有氯化钠生成,故溶液中有氯化钠和硫酸钠和稀盐酸,在加入过量的硝酸钡后,硝酸钡与硫酸钠反应生成硫酸钡沉淀和硝酸钠,故溶液中的溶质有氯化钠,硝酸钠,和稀盐酸和过量的硝酸钡,再加入硝酸银后,硝酸银与氯离子反应生成氯化银沉淀,故反应后溶液2中的溶质有硝酸钠,硝酸,硝酸钡,故阳离子有Na+、H+、Ba2+;
(4)经上面的分析,原混合物中可能有氯化钠,为了确定是否有氯化钠,可以将过量的稀盐酸代换为稀硝酸,加入硝酸银后有沉淀生成,说明一定有氯化钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)用化学式填空:石墨______ ;改良酸性土壤的碱_________。
(2)火箭推进器中装有液态肼(N2H4)和过氧化氢,当它们混合反应时,放出大量的热量,同时产生一种气态单质和一种常见的液体,写出有关反应的化学方程式_______________。
(3)在一定条件下,A和B两种物质发生反应生成C和D。下图为该反应的微观示意图。
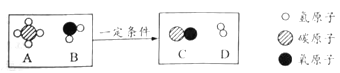
①从微观角度分析该反应的实质是______________。
②该反应中,生成C和D的质量比是___________。
(4)在托盘天平(灵敏度极高)两边各放盛有等质量、等质量分数足量稀硫酸的烧杯,天平平衡。向左烧杯中加入一定质量的金属M,同时向右烧杯中加入相同质量的金属N,观察到从反应开始至结束天平指针始终偏向右边(注:反应中都生成+2价的硫酸盐)。则:
①M、N两种金属的活动性由强到弱的顺序为____________。
②M、N两种金属的相对原子质量由大到小的顺序为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答问题:
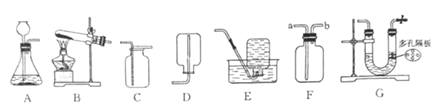
(1)实验室用高锰酸钾制取并收集较纯净的氧气,应选用的装置是________(填字母)。向气体发生装置内加入药品前应进行的操作是____________。
(2)实验室用石灰石和稀盐酸反应制取二氧化碳时,可选用发生装置A或G,G与A相比较,其优点是_________;若用F装置收集二氧化碳,检验二氧化碳已收集满的方法是______。如果要证明制取二氧化碳实验后的废液呈酸性,可选用的试剂是_______(填字母)。
a.紫色石蕊溶液 b.石灰石 c.氢氧化钠溶液 d.硝酸银溶液 e.铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】为探究CuO和稀硫酸反应后溶液中溶质的成分,同学们设计了实验、歩驟如下:
(1)取少量CuO粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液A。
(2)向歩驟(1)的試管中滴加BaCl2溶液,有白色況淀生成。得出结论:A中溶质只有CuSO4。有同学认为该结论不合理,继续迸行实验。
(3)向歩驟(2)的武管中滴加NaOH溶液,产生沉淀质量随加入NaOH溶液貭量的変化关系如图。回答下列问题:
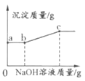
①A中的溶质有_____(填化学式),b~c之间的沉淀是___________。
②c点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要考虑____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小組为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
30
30
30
30
剩余固体的质量/g
9
6
3
2
分析数据计算(結果精确到0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质质量分数为__________。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是元素周期表中铬元素的信息,下列说法中正确的是
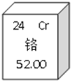
A. 铬元素原子的质子数为52 B. 铬元素的原子序数为24
C. 铬元素在地壳中的含量为52.00% D. 铬元素属于非金属元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学符号中的数字“2”表示的意义不正确的是
A. C2H5OH:“2”表示1个乙醇分子中含有两个碳原子 B. 2F:“2”表示两个氟元素
C.
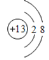 :“2”表示为K层容纳的电子数为2 D. 2NO3-:“2”表示两个硝酸根离子
:“2”表示为K层容纳的电子数为2 D. 2NO3-:“2”表示两个硝酸根离子
相关试题

