【题目】某兴趣小組为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 30 | 30 | 30 | 30 |
剩余固体的质量/g | 9 | 6 | 3 | 2 |
分析数据计算(結果精确到0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质质量分数为__________。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数为__________。
参考答案:
【答案】 83.3% 7.3% 10.5%
【解析】(1)由图可知,最终剩余固体的质量为2g,故混合物中碳酸钙的质量为12g-2g=10g,故样品中碳酸钙的质量分数为![]() ×100%=83.3% ;
×100%=83.3% ;
(2)以第一次的使用数据为准,每30g的稀盐酸可以反应3g的碳酸钙,设30g稀盐酸中溶质的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 73
3 x
![]() =
=![]() ,解得x=2.19g,故稀盐酸的质量分数为2.19g÷30g×100%=7.3%
,解得x=2.19g,故稀盐酸的质量分数为2.19g÷30g×100%=7.3%
(3)12g 的样品中碳酸钙的质量为10g,设10g的碳酸钙完全反应生成氯化钙的质量为y,生成二氧化碳的质量为m
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 111 44
10g y m
![]() =
=![]() =
=![]() ,解得y=11.1g,m=4.4g;
,解得y=11.1g,m=4.4g;
由上可知,每3g的碳酸钙与30g 的稀盐酸完全反应,故10g的碳酸钙完全反应需要稀盐酸的质量为100g,故反应后溶液的总质量为10g+100g-4.4g=105.6g
故反应后溶液中溶质的质量分数为![]() ×100%=10.5%
×100%=10.5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答问题:
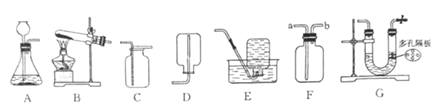
(1)实验室用高锰酸钾制取并收集较纯净的氧气,应选用的装置是________(填字母)。向气体发生装置内加入药品前应进行的操作是____________。
(2)实验室用石灰石和稀盐酸反应制取二氧化碳时,可选用发生装置A或G,G与A相比较,其优点是_________;若用F装置收集二氧化碳,检验二氧化碳已收集满的方法是______。如果要证明制取二氧化碳实验后的废液呈酸性,可选用的试剂是_______(填字母)。
a.紫色石蕊溶液 b.石灰石 c.氢氧化钠溶液 d.硝酸银溶液 e.铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】为探究CuO和稀硫酸反应后溶液中溶质的成分,同学们设计了实验、歩驟如下:
(1)取少量CuO粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液A。
(2)向歩驟(1)的試管中滴加BaCl2溶液,有白色況淀生成。得出结论:A中溶质只有CuSO4。有同学认为该结论不合理,继续迸行实验。
(3)向歩驟(2)的武管中滴加NaOH溶液,产生沉淀质量随加入NaOH溶液貭量的変化关系如图。回答下列问题:
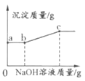
①A中的溶质有_____(填化学式),b~c之间的沉淀是___________。
②c点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要考虑____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种。为确定其组成,取少量固体加足量水溶解得到无色溶液M,进行下图实验。

试推断:
(1)白色沉淀B是______ (填化学式)。
(2)原固体中一定含有的物质是_______。
(3)无色滤液2中一定含有的阳离子是__________(填离子符号)。
(4)通过上述实验可知还有一种物质不能确定是否存在,为进一步确定,应采用的方法是____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是元素周期表中铬元素的信息,下列说法中正确的是
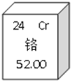
A. 铬元素原子的质子数为52 B. 铬元素的原子序数为24
C. 铬元素在地壳中的含量为52.00% D. 铬元素属于非金属元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学符号中的数字“2”表示的意义不正确的是
A. C2H5OH:“2”表示1个乙醇分子中含有两个碳原子 B. 2F:“2”表示两个氟元素
C.
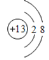 :“2”表示为K层容纳的电子数为2 D. 2NO3-:“2”表示两个硝酸根离子
:“2”表示为K层容纳的电子数为2 D. 2NO3-:“2”表示两个硝酸根离子 -
科目: 来源: 题型:
查看答案和解析>>【题目】氧气先生踏上海上“丝绸之路”即(见图),请您帮他选择行进路径,其中不能到达“目的地”是(“→”表示经一步反应转化)
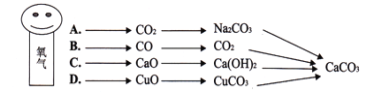
A. A B. B C. C D. D
相关试题

