【题目】下图中A~I是初中化学常见的物质,且分别是由一种至三种元素组成。I为单质,被誉为最清洁的燃料,其它均为化合物。G、D属于盐,A、E、F属于氧化物,且E中两种元素质量比为3∶8,B、C、D形成的水溶液均能使酚酞变红。图中“—”表示能相互反应,图中“→”表示转化关系,(部分反应物、生成物及反应条件已略去)。
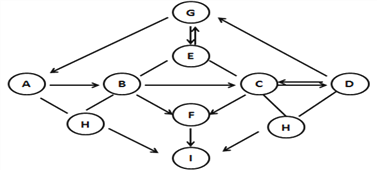
(1)写出I的化学式 _________ ;D的化学式 ____________。
(2)写出B→C反应的化学方程式_______________;写出E→G反应的化学方程式________。
(3) A→B的反应________(填“放出”或“吸收”)热量。
参考答案:
【答案】 H2 Na2CO3(K2CO3) Ca(OH)2+ Na2CO3 =CaCO3↓+2NaOH或Ca(OH)2+ K2CO3 ==CaCO3↓+2KOH CO2+ Ca(OH)2 == CaCO3↓+H2O 放出
【解析】I为单质,被誉为最清洁的燃料,所以A为氢气;A、E、F属于氧化物,且E中两种元素质量比为3∶8,所以E为二氧化碳;A~I是初中化学常见的物质,且分别是由一种至三种元素组成。G、D属于盐, B、C、D形成的水溶液均能使酚酞变红。所以D为碳酸钠或碳酸钾;由B、C、D间的转化关系可知B为氢氧化钙,C为氢氧化钠,氢氧化钙和碳酸钠反应生成氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸钠和水。氢氧化钠和氢氧化钙均能通过与非金属氧化物或酸反应转化成水,水能分解生成氢气,所以F是水。H为盐酸或硫酸,A是氧化钙。将推断结果带入关系图验证,推断成立。(1)氢气的化学式H2;D为碳酸钠或碳酸钾,化学式 Na2CO3(K2CO3);(2)氢氧化钙转化成氢氧化钠的反应化学方程式:Ca(OH)2+ Na2CO3 =CaCO3↓+2NaOH或Ca(OH)2+ K2CO3 ==CaCO3↓+2KOH ;二氧化碳转化成碳酸钙的化学方程式CO2+ Ca(OH)2 == CaCO3↓+H2O; (3) 氧化钙和水反应生成氢氧化钙,反应放出大量热量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题:
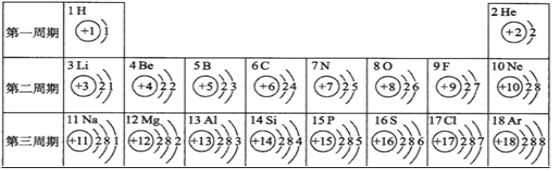
(1)不同种元素最本质的区别是_________。
(2)写出1号元素的单质在17号元素的单质中燃烧的化学方程式___________。
(3)写出8号元素与13号元素所组成物质的化学式并标出铝元素的化合价_________。
(4)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化锰可做过氧化氢分解的催化剂,氯化铁也可以。氯化铁催化过氧化氢分解的反应历程如下:
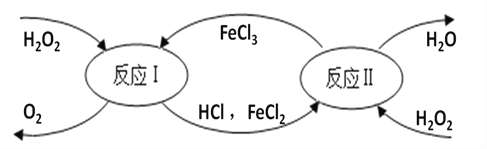
(1)写出二氧化锰催化过氧化氢分解制氧气的化学方程式 _____________________。
(2)反应Ⅰ中,反应前后化合价发生改变的元素是____________(填元素名称)。
(3)H2O和H2O2组成元素相同,但性质不同,其原因是______________。
(4)通过题目中的信息,你对催化剂的新认识是_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取某些气体的装置如下图。下列说法不正确的是
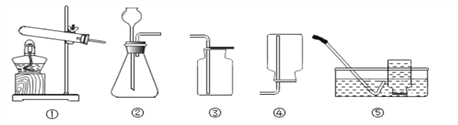
A. 实验室用氯酸钾和二氧化锰制取氧气,可选用的发生装置是①
B. 制取氢气,可选用的收集装置是④或者⑤
C. 用装置③收集氧气时,一般用燃着的木条来验满
D. 使用装置②制取二氧化碳时,为了防止漏气,长颈漏斗下端需伸入液面以下
-
科目: 来源: 题型:
查看答案和解析>>【题目】(经典赏析)我国制碱工业的先驱—侯德榜,发明了将制碱与制氨结合起来的联合制碱法。生产过程是在饱和氨盐水中(NH3和NaCl都达到饱和的溶液)通入 CO2。
(查阅资料)(1)侯氏制碱法中主要反应: Ⅰ.NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl, Ⅱ.2NaHCO3 △ Na2CO3+H2O+CO2↑。
(2) NaHCO3和NH4Cl的溶解度曲线如图所示。
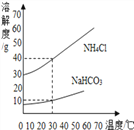
(思考交流)(1)30℃时,NH4Cl饱和溶液中溶质质量分数与NaHCO3饱和溶液中溶质质量分数相比,前者与后者的关系是_______(填字母)。
A.大于 B.小于 C.等于 D.无法确定
(2)反应Ⅰ中生成物NaHCO3和NH4Cl的质量比为_______(不需化简)。
(3)氨盐水吸收CO2后生成NaHCO3和NH4Cl,先结晶析出的物质是NaHCO3,原因是________。
(实验探究)某小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和NH4Cl。
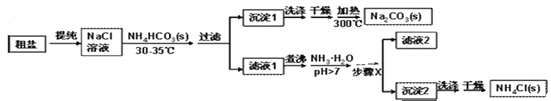
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,过滤,然后向滤液中加入适量盐酸。写出加入盐酸时反应的化学方程式_____________。
(2)过滤时玻璃棒的作用是______________ 。
(3)沉淀1表面常附有NH4+、Cl-等杂质,洗涤时最好选用下列______饱和溶液(填字母)。
A.NaCl B.NH4Cl C. NH4HCO3 D.NaHCO3
(4)步骤X包括的操作有________、冷却结晶和过滤。
(拓展延伸)小华设计下图实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀盐酸反应,通过测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
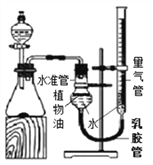
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是_________(填字母)。
A.500mL B.1000 mL C.1500 mL D.2000mL
(2) 反应结束后锥形瓶中有CO2残留,会导致测得的碳酸钠质量分数_________(填字母)。
A.偏大 B.偏小 C.无影响
(3)如果5.3g样品中钠元素的质量分数为42%,实验结束后将锥形瓶中溶液蒸干,则所得固体质量为__________(结果保留1位小数)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水与人们的生活有着密切的关系。
(1)为验证水的组成用如图所示装置进行实验。
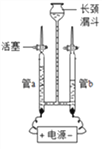
①写出该反应的化学方程式___________________________。
②电解水的过程中,发生改变的微粒是___________(写名称)。
③下列物质溶于水后能导电的是_______(填字母)。
A.蔗糖 B.氯化氢 C.氯化钠 D.氢氧化钙
(2)配制200g质量分数为5%的氢氧化钠溶液,需要氢氧化钠的质量为______,需要水_____mL。配制时用到玻璃仪器有_____、烧杯、玻璃棒和胶头滴管。(水的密度近似看作1g/cm3)
(3)用配得氢氧化钠溶液与某硫酸溶液反应,下图是利用数字化传感器得到的溶液pH变化图像。
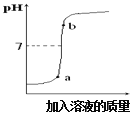
①根据图中曲线,判断进行的操作是_______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②从微观角度分析,该反应实质为_______________ 。
③b点对应的溶液中的溶质为________________写化学式)。
(4)若用溶质质量分数为9.8%的硫酸溶液50g与足量的锌完全反应,最多能得到氢气的质量是__________________?(请在答题卡上写出计算过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是探究灭火原理的四个实验,其中说法不正确的是
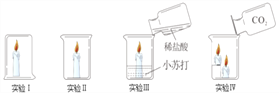
A. 实验Ⅰ中蜡烛熄灭、实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火
B. 实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳使温度降到着火点以下
C. 实验Ⅳ中蜡烛熄灭,说明二氧化碳的密度比空气大且不能燃烧不支持燃烧
D. 通过上述四个实验不能得出灭火的三个原理
相关试题

