【题目】(经典赏析)我国制碱工业的先驱—侯德榜,发明了将制碱与制氨结合起来的联合制碱法。生产过程是在饱和氨盐水中(NH3和NaCl都达到饱和的溶液)通入 CO2。
(查阅资料)(1)侯氏制碱法中主要反应: Ⅰ.NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl, Ⅱ.2NaHCO3 △ Na2CO3+H2O+CO2↑。
(2) NaHCO3和NH4Cl的溶解度曲线如图所示。
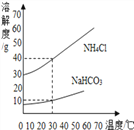
(思考交流)(1)30℃时,NH4Cl饱和溶液中溶质质量分数与NaHCO3饱和溶液中溶质质量分数相比,前者与后者的关系是_______(填字母)。
A.大于 B.小于 C.等于 D.无法确定
(2)反应Ⅰ中生成物NaHCO3和NH4Cl的质量比为_______(不需化简)。
(3)氨盐水吸收CO2后生成NaHCO3和NH4Cl,先结晶析出的物质是NaHCO3,原因是________。
(实验探究)某小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和NH4Cl。
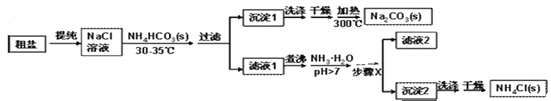
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,过滤,然后向滤液中加入适量盐酸。写出加入盐酸时反应的化学方程式_____________。
(2)过滤时玻璃棒的作用是______________ 。
(3)沉淀1表面常附有NH4+、Cl-等杂质,洗涤时最好选用下列______饱和溶液(填字母)。
A.NaCl B.NH4Cl C. NH4HCO3 D.NaHCO3
(4)步骤X包括的操作有________、冷却结晶和过滤。
(拓展延伸)小华设计下图实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀盐酸反应,通过测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
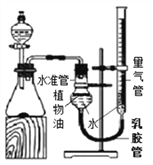
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是_________(填字母)。
A.500mL B.1000 mL C.1500 mL D.2000mL
(2) 反应结束后锥形瓶中有CO2残留,会导致测得的碳酸钠质量分数_________(填字母)。
A.偏大 B.偏小 C.无影响
(3)如果5.3g样品中钠元素的质量分数为42%,实验结束后将锥形瓶中溶液蒸干,则所得固体质量为__________(结果保留1位小数)。
参考答案:
【答案】 A 84:53.5 反应生成的碳酸氢钠的质量比氯化铵多,且相同温度下碳酸氢钠的溶解度比氯化铵小 NaOH+HCl=NaCl+H2O 引流 D 蒸发浓缩(或蒸发) C C 5.7 g(或5.6 g)
【解析】Ⅱ. (2) 【思考交流】(1) 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% 。 30℃时,氯化铵的溶解度比碳酸氢钠的溶解度大,NH4Cl饱和溶液中溶质质量分数比NaHCO3饱和溶液中溶质质量分数大;(2)化学反应中物质的质量比等于化学方程式中化学计量数和相对分子质量乘积的比, 反应NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl中,生成物NaHCO3和NH4Cl的质量比为84:53.5;(3)氨盐水吸收CO2后生成NaHCO3和NH4Cl,先结晶析出的物质是NaHCO3,原因是反应生成的碳酸氢钠的质量比氯化铵多,且相同温度下碳酸氢钠的溶解度比氯化铵小 ;【实验探究】(1)在除掉氯化镁时,加入过量的NaOH溶液,过滤,滤液中的溶质为氯化钠和氢氧化钠,向滤液中加入盐酸时,氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式NaOH+HCl=NaCl+H2O ;(2)过滤时玻璃棒的作用是引流;(3)沉淀1表面常附有NH4+、Cl-等杂质,洗涤时,为了不使碳酸氢钠溶解,最好选用碳酸氢钠饱和溶液进行洗涤;(4)步骤X包括的操作有蒸发浓缩、冷却结晶和过滤。【拓展延伸】(1)如果样品质量为5.3g,则由化学方程式:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,可计算出,生成二氧化碳2.2g,约1100mL,实验中选用的量气管规格最合适的是1500 mL; (2) 反应结束后锥形瓶中残留CO2的体积,与瓶内原有空气的体积相同,不会导致测得的二氧化碳体积不准确,不影响碳酸钠质量分数;(3)碳酸钠和盐酸反应生成氯化钠、二氧化碳、水,如果5.3g样品中钠元素的质量分数为42%,根据反应前后元素的种类、质量不变,实验结束后将锥形瓶中溶液蒸干,所得固体质量为5.3g×42%÷(23÷58.5×100%)≈5.7 g(或5.6 g)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化锰可做过氧化氢分解的催化剂,氯化铁也可以。氯化铁催化过氧化氢分解的反应历程如下:
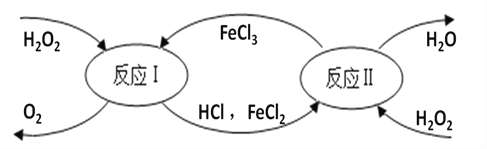
(1)写出二氧化锰催化过氧化氢分解制氧气的化学方程式 _____________________。
(2)反应Ⅰ中,反应前后化合价发生改变的元素是____________(填元素名称)。
(3)H2O和H2O2组成元素相同,但性质不同,其原因是______________。
(4)通过题目中的信息,你对催化剂的新认识是_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取某些气体的装置如下图。下列说法不正确的是
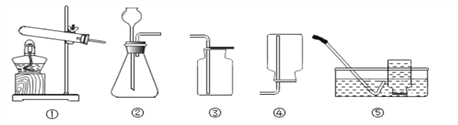
A. 实验室用氯酸钾和二氧化锰制取氧气,可选用的发生装置是①
B. 制取氢气,可选用的收集装置是④或者⑤
C. 用装置③收集氧气时,一般用燃着的木条来验满
D. 使用装置②制取二氧化碳时,为了防止漏气,长颈漏斗下端需伸入液面以下
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中A~I是初中化学常见的物质,且分别是由一种至三种元素组成。I为单质,被誉为最清洁的燃料,其它均为化合物。G、D属于盐,A、E、F属于氧化物,且E中两种元素质量比为3∶8,B、C、D形成的水溶液均能使酚酞变红。图中“—”表示能相互反应,图中“→”表示转化关系,(部分反应物、生成物及反应条件已略去)。
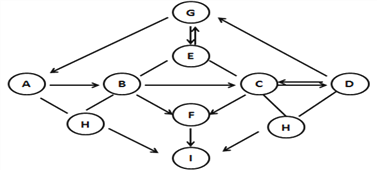
(1)写出I的化学式 _________ ;D的化学式 ____________。
(2)写出B→C反应的化学方程式_______________;写出E→G反应的化学方程式________。
(3) A→B的反应________(填“放出”或“吸收”)热量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水与人们的生活有着密切的关系。
(1)为验证水的组成用如图所示装置进行实验。
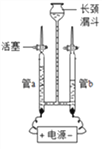
①写出该反应的化学方程式___________________________。
②电解水的过程中,发生改变的微粒是___________(写名称)。
③下列物质溶于水后能导电的是_______(填字母)。
A.蔗糖 B.氯化氢 C.氯化钠 D.氢氧化钙
(2)配制200g质量分数为5%的氢氧化钠溶液,需要氢氧化钠的质量为______,需要水_____mL。配制时用到玻璃仪器有_____、烧杯、玻璃棒和胶头滴管。(水的密度近似看作1g/cm3)
(3)用配得氢氧化钠溶液与某硫酸溶液反应,下图是利用数字化传感器得到的溶液pH变化图像。
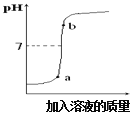
①根据图中曲线,判断进行的操作是_______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②从微观角度分析,该反应实质为_______________ 。
③b点对应的溶液中的溶质为________________写化学式)。
(4)若用溶质质量分数为9.8%的硫酸溶液50g与足量的锌完全反应,最多能得到氢气的质量是__________________?(请在答题卡上写出计算过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是探究灭火原理的四个实验,其中说法不正确的是
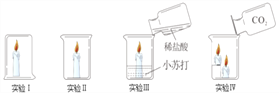
A. 实验Ⅰ中蜡烛熄灭、实验Ⅱ中蜡烛不熄灭,说明隔绝空气可以灭火
B. 实验Ⅲ中蜡烛熄灭,因为稀盐酸与小苏打反应生成二氧化碳使温度降到着火点以下
C. 实验Ⅳ中蜡烛熄灭,说明二氧化碳的密度比空气大且不能燃烧不支持燃烧
D. 通过上述四个实验不能得出灭火的三个原理
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是
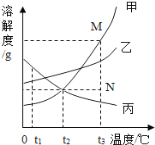
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
相关试题

