【题目】一包白色固体中可能含有氯化钠、硫酸铜、硫酸镁、硝酸钡中的一种或多种,加水溶解得到无色溶液A,某化学兴趣小组按如下流程继续进行实验检验原白色固体成分。
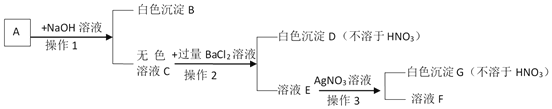
①操作1的名称为_____,用到的主要玻璃仪器为_____;
②白色沉淀B的化学式为_____;
③溶液E中一定含有的溶质是_____;
④白色固体组成情况为_____。
参考答案:
【答案】 过滤 漏斗、烧杯、玻璃棒 Mg(OH)2 氯化钡、氯化钠 ①硫酸镁; ②硫酸镁、氯化钠;
【解析】(1)几种物质加水溶解后得到无色溶液A,说明原混合物中一定没有硫酸铜,加入氢氧化钠后有白色沉淀生成,说明原混合物中一定有硫酸镁,则一定没有硝酸钡,操作1是将固液分离的过程,故是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)加入氢氧化钡后有白色沉淀生成,生成的沉淀只能是氢氧化镁,化学式为Mg(OH)2,
(3)向溶液E中加入硝酸银,有不溶于硝酸的白色沉淀生成,说明原溶液中一定有氯化钠,故E溶液中一定有氯化钠和过量的氯化钡;
(4)由上分析,原混合物中有硫酸镁、氯化钠;
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象能正确反映对应变化关系的是( )
A.
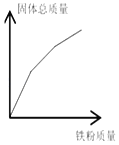 硝酸铜和硝酸银的混合溶液中加入铁粉
硝酸铜和硝酸银的混合溶液中加入铁粉B.
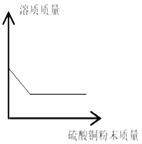 一定量的饱和硫酸铜溶液中加入硫酸铜粉末
一定量的饱和硫酸铜溶液中加入硫酸铜粉末C.
 混有盐酸的氯化钙溶液中滴加碳酸钠溶液
混有盐酸的氯化钙溶液中滴加碳酸钠溶液D.
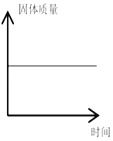 镁带在密闭容器中燃烧
镁带在密闭容器中燃烧 -
科目: 来源: 题型:
查看答案和解析>>【题目】某小组同学利用如图2溶解度曲线和图1进行实验,并完成下列问题
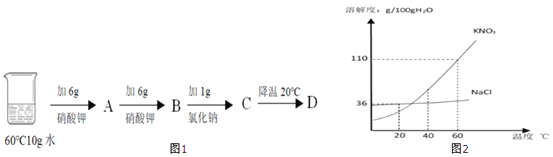
①20℃时,氯化钠的溶解度为_____。
②40℃时,硝酸钾的溶解度_____氯化钠的溶解度(用“>”“<”“=”填空)
③A中溶液为60℃硝酸钾的_____溶液(填“饱和”或“不饱和”)
④B中溶液的质量为_____克
⑤将D过滤,下列有关所得晶体和溶液说法正确的是_____(填字母)。
Ⅰ.析出的晶体中可能含有氯化钠
Ⅱ.所得溶液中一定含有硝酸钾和氯化钠
Ⅲ.C→D过程可以完全分离硝酸钾和氯化钠
Ⅳ.所得溶液一定是硝酸钾的饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用下列提供的仪器装置回答问题:
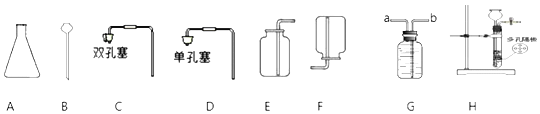
①仪器名称:A为_____
②小丽用双氧水和二氧化锰制取氧气时,发现反应速率过快,小丽思考后将所用仪器B改为_____,该反应的化学方程式为_____,若使用装置G收集氧气,氧气应从_____(填“a”或“b”)端通入。
③小明选用A到G中仪器,组装出实验室制取二氧化碳装置,他所选仪器有_____(填写一套即可),反应的化学方程式为_____。
④小刚选用H装置放入锌粒和稀硫酸制取氢气,H装置的优点是_____,反应一段时间后他关闭活塞,发现装置中固液无法分离,原因可能为_____(写出一种即可);
⑤小刚用制得的氢气还原氧化铜,得到0.1mol铜,则理论上参与反应的氢气的质量为_____(根据化学方程式计算)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习氢氧化钠化学性质时,某化学兴趣小组设计以下实验,探究氢氧化钠与二氧化碳是否发生反应及所得溶液的溶质成分。
①从反应物减少角度探究氢氧化钠与二氧化碳是否反应。
实验操作如图所示,观察到软塑料瓶变瘪,认为氢氧化钠与二氧化碳反应了,反应的化学方程式为_____;一位同学认为此实验操作及现象不足以证明氢氧化钠与二氧化碳发生了反应,其理由是_____;小组同学进一步思考讨论后,他们用和甲相同的充满二氧化碳的软塑料瓶,加入_____,做了对照实验,完善了方案。

②从生成物角度探究氢氧化钠与二氧化碳是否反应,取上述方案C中的溶液少许,滴加_____,观察到有产生气泡,证明氢氧化钠与二氧化碳发生了反应。
③探究方案①中C的溶质成分
实验步骤
实验现象
实验结论
步骤一:取少量样品,滴加___________
产生白色沉淀
溶质成分为_____
步骤二:_____
_____
-
科目: 来源: 题型:
查看答案和解析>>【题目】青石棉是世界卫生组织确定的一种致癌物质,青石棉的化学式为Na2Fe5Si8O22(OH)2。
①青石棉由_________种元素组成;
②青石棉分子中钠原子和硅原子的原子个数之比为________;
③青石棉中元素质量分数最小的为_________元素;
④0.5mol青石棉中约含有_______________个钠原子(用科学计数法表示);
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是A、B、C三种物质的溶解度曲线。下列叙述错误的是

A. t1℃时,三种物质的溶解度大小顺序为A<B<C
B. t2℃时,A、B两种物质的溶解度相等
C. t3℃时B的饱和溶液降温到t1℃,变成不饱和溶液
D. 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法
相关试题

