【题目】为了测得工业纯碱中碳酸钠的质量分数(常含少量NaCl),小明同学设计的实验装置如图甲,准确称取一定量的纯碱样品,从分液漏斗中滴入稀硫酸。已知碱石灰既能吸收水也能吸收二氧化碳。

(1)图甲中仪器a内发生的化学方程式为______________________。
(2)小红觉得小明的实验装置会导致较大的误差,故设计了图乙的装置,请你写出图乙装置的优势(写出两点即可):_________________、______________。
(3)小红用图乙装置进行实验,步骤为:①准确称取盛有碱石灰的干燥管的质量为158.0 g,再准确称取11.0 g纯碱样品并全部放入A中;②组装全部反应装置并检查气密性,关闭d;由e逐滴加入稀硫酸至不再产生气泡为止;③打开d,慢慢鼓入空气10 min;④再称干燥管的总质量为162.4 g。该产品中碳酸钠的质量分数为_______________(结果精确到0.1%)。
参考答案:
【答案】 Na2CO3+H2SO4![]() Na2SO4+H2O+CO2↑ 能够防止水蒸气对实验的干扰 能使反应生成的二氧化碳全部被碱石灰吸收 96.4%
Na2SO4+H2O+CO2↑ 能够防止水蒸气对实验的干扰 能使反应生成的二氧化碳全部被碱石灰吸收 96.4%
【解析】(1)碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳;(2)实验装置不同,优缺点不同;
(3)干燥管在反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳质量和反应的化学方程式可以计算碳酸钠质量,进一步可以计算该产品中碳酸钠的质量分数。(1)图甲中,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,发生的化学方程式为Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;(2)图乙装置的优点是:二氧化碳中的水蒸气能被C装置中的浓硫酸吸收,能够防止水蒸气对实验的干扰,实验结束后打开d,慢慢鼓入空气10min,能使反应生成的二氧化碳全部被碱石灰吸收;
(3)设碳酸钠质量为x。
反应生成二氧化碳质量为162.4g-158.0g=4.4g
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
10644
x 4.4g![]()
x=10.6g,
该产品中碳酸钠的质量分数为![]() ×100%=96.4%
×100%=96.4%
答:该产品中碳酸钠的质量分数为96.4%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用氯化钠固体配制溶质的质量分数为10%的氯化钠溶液50g。下列做法不正确的是
A. 称量:用天平称量氯化钠5g B. 量取:用量筒量取蒸馏水45mL
C. 溶解:将氯化钠倒入量筒中溶解 D. 转移:将配好的溶液转移至试剂瓶
-
科目: 来源: 题型:
查看答案和解析>>【题目】现欲探究一固体混合物A的成分,已知其中可能含有CuSO4、CaCO3、NH4NO3、Cu四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
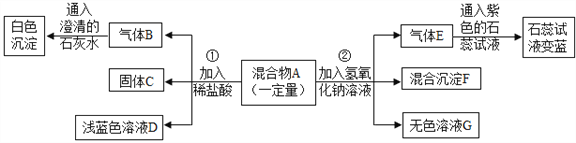
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)气体E的气味是_____________________________。
(2)在混合物A中,共含有_____________种物质。
(3)固体C的化学式为_______________。
(4)溶液G中存在的金属阳离子为(写离子符号)_____________。
(5)写出实验过程①中所发生反应的化学方程式:________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某黑色固体粉末可能是Fe、FeO、CuO、C中的一种或几种。为了探究其成分,小明同学按照如图所示流程进行了实验。

关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定有Fe;②若步骤Ⅱ中无明显现象,则固体乙中一定有Cu;③若步骤Ⅱ中有气泡产生,则固体乙一定只有C;④若步骤Ⅱ中有红色固体析出,则固体乙中一定无Fe。以上说法中正确的是
A. ①②③④ B. ②③④ C. ②④ D. ④
-
科目: 来源: 题型:
查看答案和解析>>【题目】稀土钨是重要的战略金属资源,钨矿在古代被称为“重石”,在元素周期表中钨元素的某些信息如图所示,下列有关钨的说法正确的是( )
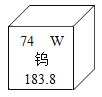
A. 原子核内质子数为74 B. 相对原子质量为183.8g
C. 属于非金属元素 D. 原子核内中子数为74
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如右图所示。下列说法正确的是
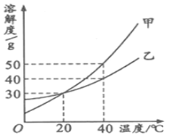
A.20℃时,甲溶液中溶质的质量分数一定比乙溶液的大
B.将40℃时甲的一定量饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】用“○”和“●”分别代表两种不同元素的原子,这两种元素组成的化合物在一定条件下,能发生以下反应 反应前后的微观模拟图如下下列说法正确的是
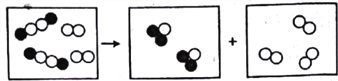
A. 该反应中反应物是一种单质和一种化合物
B. 在反应中,两种生成物的分子个数比为2:3
C. 符合该形式的化学方程式可以是
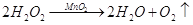
D. 该反应的基本反应类型是置换反应
相关试题

