【题目】现欲探究一固体混合物A的成分,已知其中可能含有CuSO4、CaCO3、NH4NO3、Cu四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
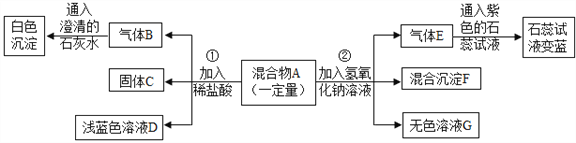
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)气体E的气味是_____________________________。
(2)在混合物A中,共含有_____________种物质。
(3)固体C的化学式为_______________。
(4)溶液G中存在的金属阳离子为(写离子符号)_____________。
(5)写出实验过程①中所发生反应的化学方程式:________________________。
参考答案:
【答案】 刺激性气味 4 Cu Na+ CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
【解析】CuSO4、CaCO3、NH4Cl、Cu四种物质中能与盐酸反应产生气体的是碳酸钙,气体B通入澄清石灰水中,石灰水变浑浊,因此气体B为二氧化碳,CuSO4溶于水是蓝色溶液,故A中一定含有CuSO4,D为CuSO4溶液;加入盐酸后还有不溶于盐酸的固体,故A中一定含有铜,故C为铜;A中加入氢氧化钠溶液产生气体,能与氢氧化钠溶液产生气体的只有氯化铵,铵盐与氢氧化钠产生的氨气与紫色石蕊试液反应,石蕊试液变为蓝色因此A中一定含有NH4NO3。(1)由上述分析可知E为氨气,有刺激性气味;(2)由上述分析可知混合物A中共有CuSO4、CaCO3、NH4NO3、Cu四种物质;(3)由于铜不与盐酸反应,故固体C为铜;(4)溶液G为氢氧化钠与CuSO4、NH4NO3反应后的溶液,溶液中的溶质为硫酸钠、硝酸钠,故溶液中的金属离子为Na+;(5)实验过程①中所发生反应是碳酸钙和盐酸反应生成氯化钙、二氧化碳、水,故反应化学方程式为CaCO3 + 2HCl == CaCl2 + H2O + CO2↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。

(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
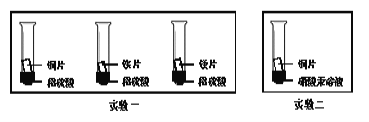
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A. 滤纸上一定有Fe,可能有Mg、Cu
B. 滤纸上一定有Cu,可能有Fe,一定没有Mg
C. 滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D. 滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组
第Ⅱ组
第Ⅲ组
稀硫酸的质量/g
50
100
150
溶解固体的质量/g
10.0
16.0
16.0
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
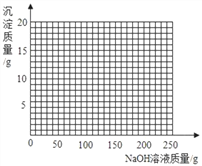 ___________________
___________________ -
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语书写正确的是
A. 3个铵根离子:3NH4+ B. 2个氮原子:N2
C. 五氧化二磷分子:O2P5 D. 标出过氧化氢中氧元素的化合价:H2O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】用氯化钠固体配制溶质的质量分数为10%的氯化钠溶液50g。下列做法不正确的是
A. 称量:用天平称量氯化钠5g B. 量取:用量筒量取蒸馏水45mL
C. 溶解:将氯化钠倒入量筒中溶解 D. 转移:将配好的溶液转移至试剂瓶
-
科目: 来源: 题型:
查看答案和解析>>【题目】某黑色固体粉末可能是Fe、FeO、CuO、C中的一种或几种。为了探究其成分,小明同学按照如图所示流程进行了实验。

关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定有Fe;②若步骤Ⅱ中无明显现象,则固体乙中一定有Cu;③若步骤Ⅱ中有气泡产生,则固体乙一定只有C;④若步骤Ⅱ中有红色固体析出,则固体乙中一定无Fe。以上说法中正确的是
A. ①②③④ B. ②③④ C. ②④ D. ④
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了测得工业纯碱中碳酸钠的质量分数(常含少量NaCl),小明同学设计的实验装置如图甲,准确称取一定量的纯碱样品,从分液漏斗中滴入稀硫酸。已知碱石灰既能吸收水也能吸收二氧化碳。

(1)图甲中仪器a内发生的化学方程式为______________________。
(2)小红觉得小明的实验装置会导致较大的误差,故设计了图乙的装置,请你写出图乙装置的优势(写出两点即可):_________________、______________。
(3)小红用图乙装置进行实验,步骤为:①准确称取盛有碱石灰的干燥管的质量为158.0 g,再准确称取11.0 g纯碱样品并全部放入A中;②组装全部反应装置并检查气密性,关闭d;由e逐滴加入稀硫酸至不再产生气泡为止;③打开d,慢慢鼓入空气10 min;④再称干燥管的总质量为162.4 g。该产品中碳酸钠的质量分数为_______________(结果精确到0.1%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】稀土钨是重要的战略金属资源,钨矿在古代被称为“重石”,在元素周期表中钨元素的某些信息如图所示,下列有关钨的说法正确的是( )
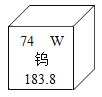
A. 原子核内质子数为74 B. 相对原子质量为183.8g
C. 属于非金属元素 D. 原子核内中子数为74
相关试题

