【题目】已知NaHCO3在270 ℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解。现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案。
方案一:样品![]() 测定生成CO2的质量。
测定生成CO2的质量。
(1)NaHCO3俗称_______,本实验采用如图所示的装置,C中盛放的物质是_______。
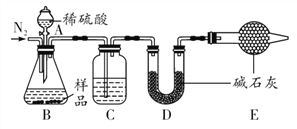
(2)若无装置E,在其他操作正确的情况下,_______(填“能”或“不能”)准确测定样品中NaHCO3的质量分数。
(3)在其他操作正确的情况下,不能将分液漏斗中的稀硫酸改为稀盐酸的原因是___________。
方案二:样品![]() 测定剩余固体质量
测定剩余固体质量
具体操作步骤如下:
①取一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克。
(4)实验时需要重复“加热、冷却、称量”操作多次,其目的是__________________。
(5)根据题目中的信息,写出NaHCO3完全分解的化学方程式__________________。
(6)根据题意,计算样品中NaHCO3的质量分数为_____________。(请写出计算过程)
参考答案:
【答案】 小苏打 浓硫酸 不能 盐酸具有挥发性,D中的碱石灰既吸收生成的CO2,还会吸收挥发出来的HCl气体,使测定结果偏大 使碳酸氢钠完全分解 2NaHCO3 △ Na2CO3+H2O+CO2↑ 84%
【解析】(1)根据NaHCO3俗称为小苏打解答,根据碱石灰会吸收水分和二氧化碳进行分析;(2)根据E的作用是防止空气中的水和二氧化碳进入D解答;(3)根据碱石灰是碱性干燥剂,盐酸具有挥发性进行分析;(4)根据实验时需要重复“加热、冷却、称量”操作多次,可以使碳酸氢钠完全分解进行分析;(5)根据根据题目中的信息,写出NaHCO3完全分解的化学方程式解答;(6)根据实验过程中减少的质量是水和二氧化碳的质量进行分析。(1)NaHCO3俗称为小苏打;碱石灰会吸收水分和二氧化碳,实验在用碱石灰吸收二氧化碳之前,需要将气体干燥,C中盛放的物质是浓硫酸;(2)E的作用是防止空气中的水和二氧化碳进入D,否则,若无装置E,在其他操作正确的情况下,不能准确测定样品中NaHCO3的质量分数;(3)碱石灰是碱性干燥剂,盐酸具有挥发性,D中的碱石灰既吸收生成的CO2,还会吸收挥发出来的HCl气体,使测定结果偏大;(4)实验时需要重复“加热、冷却、称量”操作多次,可以使碳酸氢钠完全分解;(5)NaHCO3完全分解的化学方程式为:2NaHCO3![]()
Na2CO3+H2O+CO2↑;(6)实验过程中减少的质量是水和二氧化碳的质量,固体减少质量为41.2g-35g=6.2g;设样品中含有碳酸氢钠为x。
2NaHCO3![]() Na2CO3+H2O+CO2↑ 固体减少
Na2CO3+H2O+CO2↑ 固体减少
168 62
x 6.2g![]()
x=16.8g
样品中碳酸氢钠为41.2g-21.2g=20g
所以样品中NaHCO3的质量分数=![]() ×100%=84%
×100%=84%
答:样品中NaHCO3的质量分数为84%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】CO2、O2、H2是中学化学中常见的气体,请根据下列装置图回答问题:
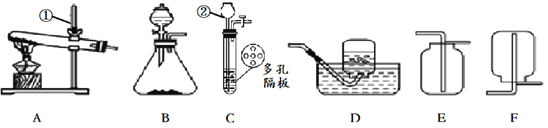
(1)写出图中仪器的名称:①___________,②_____________。
(2)实验室制取CO2的发生装置应选用________(用字母A~F填空)装置,该反应的化学方程式为_____________________。
(3)实验室用A装置制取O2的化学方程式是____________________,实验室用B装置制取O2时,加入的固体起________作用。
(4)实验室可用B装置或C装置制取H2,C装置与B装置比较的优点是_______;收集H2选用的装置是D或F,其原因是______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成分之一,其溶液为蓝色,F是由三种元素组成的化合物。请回答下列问题:
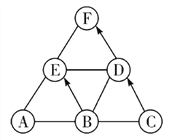
(1)写出化学式:D________,F________。
(2)物质C所属的物质类别是________,选择C作为食品干燥剂的原因有_______________(答两条即可)。
(3)写出A与E反应的化学方程式____________________。
(4)B在生产上的用途有____________,上述反应没有包含的基本反应类型是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学进行如图两个实验。
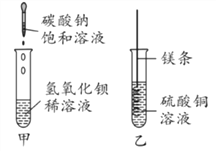
(1)甲实验中反应的化学方程式为________________________________。
(2)乙实验观察到的现象是__________________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ.________;
Ⅱ.Mg(OH)2和BaSO4;
Ⅲ.Mg(OH)2和MgCO3。
(实验方案)
实验操作
实验现象与结论
过滤、洗涤白色沉淀备用;向白色沉淀加入盐酸至过量
①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为__________________。
②若________________且无气体产生,猜想Ⅱ成立。
③若沉淀完全溶解,____________,猜想Ⅲ成立。
(反思评价)如果猜想Ⅲ成立,产生此结果的原因是做甲实验时________________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是:_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组的同学对一包久置的生石灰(CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
【提出问题】这包干燥剂是否变质,成分是什么?
【猜想假设】猜想一:全部是CaO; 猜想二:是CaO和Ca(OH)2的混合物;
猜想三:全部是Ca(OH)2; 猜想四:是Ca(OH)2和CaCO3的混合物。
【实验探究】(1)取部分该干燥剂于试管中,加水无放热现象,说明干燥剂中不含 。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有 。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下二种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于3支试管中。请你参与实验,并填写表中的空白:
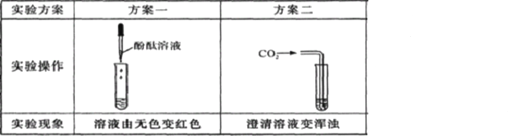
写出方案二发生的化学反应方程式 。
【实验结论】通过以上实验探究,得出猜想 成立。
【拓展迁移】小组同学反思生石灰干燥剂变质原因,认识到实验室保存氧化钙应注意 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图表示化学反应中溶液的颜色变化。下列叙述错误的是
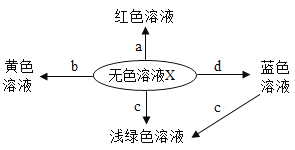
A. 若X是稀硫酸,a可能是紫色石蕊试液 B. 若X是稀硫酸,b可能是氧化物
C. 若X是稀盐酸,c不可能是单质 D. 若X是稀盐酸,d不可能是单质
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是小组中的几位同学对其中的成分进行了探究。

(提出猜想)小丹认为含有:CaO、Ca(OH)2;
小凯认为含有:CaO、Ca(OH)2、CaCO3;
小欣认为含有:Ca(OH)2、CaCO3。
(设计实验)
实验操作
实验现象
结论
步骤一
取试样于试管中加水振荡
液体浑浊,用手摸试管外壁,感觉不发热
______________________
步骤二
向步骤一的试管中滴加无色酚酞溶液
溶液变红色
______________________
步骤三
_______________________
试管内有气泡生成
一定含有CaCO3
(得出结论)通过以上探究可知_________同学的猜想正确,请写出使CaO变质的化学方程式:______。
(拓展)如果生石灰已全部变质为碳酸钙,请你设计实验加以证明(写出必要的步骤、现象和结论)___。
相关试题

