【题目】(1)某实验小组的同学用碳酸钠粉末、块状大理石、稀盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取C02。请你参与下列的探究并回答问题:
(提出问题)上述酸和碳酸盐的反应是否适合在实验室制取C02?
Ⅰ.设计了如下三个实验进行对比
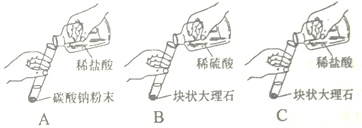
(实验与结论)
Ⅱ.请你填写实验报告
实验 | 实验现象 | 实验内容 |
A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,不便收集气体,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生二氧化碳,不能用于实验室制取二氧化碳 |
C | ①______; | ②______; |
Ⅲ.根据探究结论,实验室制取二氧化碳的反应原理为______(用化学方程式表示)
(2)取四朵用石蕊溶液染成紫色的干燥纸花完成如下实验。
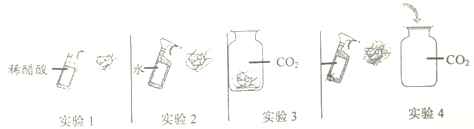
①该同学进行的实验1、2两项实验说明了酸能使紫色石蕊溶液变红;则该同学进行的实验3、4两项实验说明了______。
②写出实验4中发生反应的化学方程式:______。
③若将第四朵小花取出,小心烘烤,可观察到的现象是______。
参考答案:
【答案】产生大量气泡 反应速率适中,便于收集气体 CaCO3+2HCl==CaCl2+H2O+CO2↑ 二氧化碳与水反应生成酸(或碳酸) CO2+H2O==H2CO3 变红色的纸花又变成紫色
【解析】
本题主要考查实验室制取二氧化碳药品的选择和二氧化碳的化学性质。
(1)稀盐酸和大理石反应是实验室制取二氧化碳的方法,稀盐酸和大理石中的碳酸钙反应能够产生大量气泡,速率适中且持久,便于收集,因此适用于实验室制取二氧化碳,故答案为:产生大量气泡;
(2)由(1)的分析可知,实验内容为:反应速率适中,便于收集气体,故答案为:反应速率适中,便于收集气体;
(3)稀盐酸和大理石反应产生氯化钙、水和二氧化碳,因此反应的原理为:CaCO3+2HCl=CaCl2+H2O+CO2↑,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)二氧化碳本身不显酸性,不能使石蕊变色,与水反应生成的碳酸显酸性,能使石蕊变红;故答案为:二氧化碳与水反应生成酸(或碳酸);
(5)二氧化碳能与水反应生成碳酸,反应化学方程式为:CO2+H2O=H2CO3,故答案为:CO2+H2O=H2CO3;
(6)碳酸不稳定,受热易分解生成二氧化碳和水,使酸性消失,因此花由红色变为紫色,故答案为:变红色的纸花又变成紫色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下是某化学反应的微观示意图
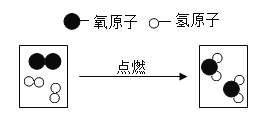
(1)该反应的化学方程式为______;
(2)以上变化的基本反应类型是______;
(3)结合上图,从原子、分子的角度分析,在化学反应过程中______可分,而______不能再分。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、D,E、F、G,M是初中常见物质,分别由c、H、0中的一种或两种元素组成,M完全燃烧生成A和D,A能使澄清石灰水变浑浊,E、G为单质。它们之间关系如图所示,图中“→”表示由某一物质可生成另一物质(部分反应物、生成物及反应条件略去)
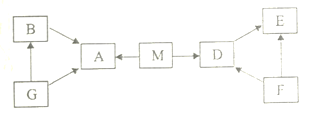
(1)M—定含有的元素是______;
(2)F的化学式:______;
(3)①A使澄清石灰水变浑浊的化学方程式:______;②G→B的化学方程式:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为实验室常用的装置:

(1)仪器a的名称是______;组装A装置时,酒精灯应在固定试管之______(填“前”或“后”)放置。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式:______,宜选用的发生装置是______(填装置标号,下同),不宜选用的收集装置是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】比较与归纳是学习化学的重要方法。对于以下三个化学方程式:
2Mg+O2
 2Mg0
2Mg02H2+02
 2H20
2H202C0+O2
 2C02
2C02(1)通过比较,发现它们有许多共同点。请你写出其中两点:①______;②______。请再写出一个具有以上共同点的化学方程式______。
(2)以上化学方程式也有许多不同之处,请你写出其中一个与另两个的一点不同之处______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们从山上采集到一种石灰石,他们取40克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t/s
t0
t1
t2
t3
t4
t5
t6
反应后固体的质量m/g
40
37.5
35
33
31
29
29
请回答下列问题:
(1)当石灰石完全反应后,生成C02的质量为______g。
(2)求该石灰石中CaC03的质量分数,写出计算过程______。
-
科目: 来源: 题型:
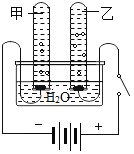
查看答案和解析>>【题目】在如图电解水的实验中,甲试管内产生的气体是_____,检验乙试管内产生的气体方法是_____。两者的体积之比为_____。此实验说明水是由_____组成,写出此反应的文字表达式_____。
相关试题

