【题目】为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 _______.
(2)发生反应的化学方程式为________.
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(X)的比例式为________.
(4)该黄铜样品中铜的质量分数是________ .
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是 ________ .
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干.然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是_______,再经过某些反应操作就得到了所需铜盐.
参考答案:
【答案】40gZn+2HCl═ZnCl2+H2↑![]() =
=![]() 80%13.6%107g
80%13.6%107g
【解析】
(1)设需要质量分数为36.5%的浓盐酸的质量是x,100g×14.6%=x×36.5%,解得:x=40g;
(2)铜不能和稀盐酸反应,锌和稀盐酸反应生成了氯化锌和氢气,该反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(3)反应生成氢气的质量为:100g+100g-199.6g=0.4g,设合金中锌的质量为x,反应生成氯化锌的质量为y,
Zn+2HCl═ZnCl2+H2↑
65 136 2
x y 0.4g
![]() x=13g,
x=13g,
![]() y=27.2g,
y=27.2g,
(4)该黄铜样品中铜的质量分数是![]() ×100%=80%;
×100%=80%;
(5)最终所得溶液中溶质的质量分数为:![]() ×100%=13.6%;
×100%=13.6%;
(6)铜锌合金中铜的质量为:100g×(1-7%)-13g=80g,设80g铜和氧气反应能够生成氧化铜的质量为a,
2Cu+O2![]() 2CuO
2CuO
128 160
80g a
![]()
a=100g,
所以可以得到含杂质的氧化铜的质量为:100g+100g×7%=107g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水的作用不可忽视.如图中五个实验分别用到水.
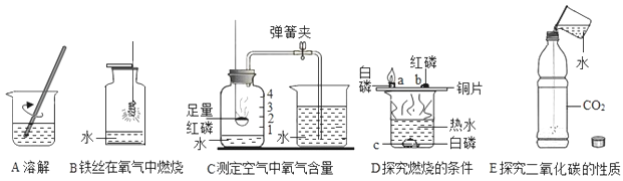
请回答下列问题:
(1)实验A中水作________(填“溶剂”或“溶质”),玻璃棒的作用________;
(2)实验B中反应的化学方程式为________,集气瓶中水的作用是________;
(3)实验C中反应的化学方程式是________,烧杯中的水进入集气瓶中的原理是________;
(4)实验D中水的作用是提供热量和________;
(5)用化学方程式表示实验E中水的作用________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示。
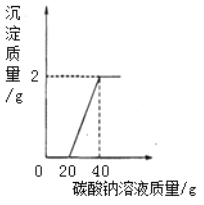
试回答:
(1)分析图中信息可知,20g废液中,所含的溶质是 (写化学式);
(2)在废液中加入碳酸钠溶液,首先与碳酸钠溶液反应的化学方程式为 ;
(3)计算废液中氯化钙的质量分数是多少?(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】“水是生命的载体”,水与人类生活和生产关系密切,请回答下列问题.
(1)①水能溶解很多物质,是配制溶液时最常用的________ .
②保持水的化学性质的最小粒子是________ .
(2)自然水经过处理可直接饮用.其处理步骤可用如图甲表示:
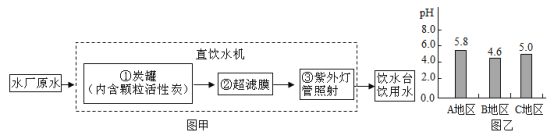
步骤①的作用是 ________.(填字母,下同),步骤③的作用是 ________.
A.杀菌消毒 B.吸附杂质
(3)降雨是自然界中水循环的一个环节.酸雨是由 ________、NO2气体或这些气体在空气中反应后的生成物溶于雨水所形成.A、B、C三个地区雨水的pH如图乙所示,其中 ________地区的雨水是酸雨.
-
科目: 来源: 题型:
查看答案和解析>>【题目】氨基乙腈广泛应用于药品的一种原料.如图是氨基乙腈的分子结构模型,下列说法正确的是

A.氨基乙腈是由碳、氢、氮三种原子构成的
B.氨基乙腈中碳、氢、氮原子的个数比为1:2:1
C.一个氨基乙腈分子有8个原子,56个质子
D.氨基乙腈是一种有机高分子化合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学符号表示:3个氧分子________;2个铝原子________;1个钠离子________;2个亚铁离子________;2个铝离子________;钾元素的化合价为正一价________;硫酸________;高锰酸钾________;硝酸铁________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请用化学用语填空。
① 5 个氮气分子________;
② 3 个氧离子________;
③ 一氧化氮中氮元素的化合价为+2 价________;
④ 水通电分解过程中,不变的微粒是________;
⑤ 焙制糕点所用的发酵粉中含有的小苏打________;
⑥ 我国是最早生产钢铁的国家之一,请写出炼铁的反理________。
相关试题

