【题目】实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示。
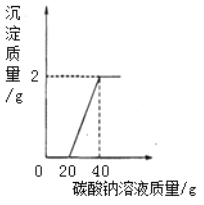
试回答:
(1)分析图中信息可知,20g废液中,所含的溶质是 (写化学式);
(2)在废液中加入碳酸钠溶液,首先与碳酸钠溶液反应的化学方程式为 ;
(3)计算废液中氯化钙的质量分数是多少?(写出计算过程)
参考答案:
【答案】(1)CaCl2和HCl
(2)Na2CO3+2HCl=2NaCl+ H2O +CO2↑
(3)11.1%
【解析】碳酸钙和盐酸反应的方程式为: CaCO3 +2HCl ==CaCl2+ CO2↑ + H2O ,因此可知反应后的溶液中一定有氯化钙,可能有氯化氢。由图可知开始没生成沉淀说明滤液中有两种溶质,为氯化钙和氯化氢,开始发生的是碳酸钠和盐酸反应生成二氧化碳、氯化钠、水的反应,方程式为Na2CO3+2HCl=2NaCl+ H2O +CO2↑;设废液中氯化钙的质量为x,
CaCl2+Na2CO3=CaCO3↓+2NaCl,
111 100
X 2g
111/x=100/2g
X=2.22g
废液中氯化钙的质量分数是2.22g÷20g×100%=11.1%
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)图甲是镁原子和氧原子形成氧化镁的示意图
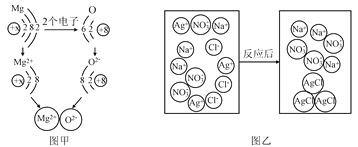
①从得失氧的角度看,镁与氧气的反应属于____ 反应;从得失电子的角度看,反应中镁原子______(填“得到”或“失去”)2个电子,形成相对稳定结构。
②由图甲可知,元素的原子得到电子后,其化合价将______(填“升高”或“降低”)。
(2)图乙是NaCl与AgNO3两溶液反应的示意图。
①图中NO3﹣的名称是______________ 。
②该反应的本质是__________________结合生成沉淀。
③请再用AgNO3作反应物之一,写出另一个与上述反应本质相同的化学方程式:____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016届江苏省徐州市王杰中学九年级(上)第一周周测】专家把绿色植物通过光合作用转化的食物叫做绿色食品,海洋提供的食品叫做蓝色食品,通过微生物发酵制得的食品叫做白色食品.下列属于白色食品的是( )
A.面粉 B.海带 C.食醋 D.食盐
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质王国举行击鼓传花的游戏。某学习小组由铁、氢气、氧化铜、二氧化碳、稀硫酸、氢氧化钠、氯化铜七名成员组成。游戏的规则是:相互之间能发生反应就可以进行传递。请把上述成员安排在A—G的相应位置上,使花束能从A传到G。其中A为组长,其固体俗称为干冰。F为副组长,其为黑色固体,请回答:
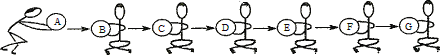
(1)氢氧化钠应放在位置 _______上。
(2)C和D反应的化学方程式为_________,反应类型为______(填基本反应类型)。
(3)上述物质除了发生从A到G的化学反应外,常温下,还能相互发生反应的是:
____________(用化学方程式表示)。
(4)当G换成另一个与G同类别的物质时就能将花束传回起点A,它是_________(填物质名称)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列事实与化学没有密切关系的是
A.食物、衣料和日常用品的丰盛 B.新材料的开发和利用
C.环境污染的预防和治理 D.物体机械运动的规律
-
科目: 来源: 题型:
查看答案和解析>>【题目】水者, 万物之本。
(1) 水的保护
①保护水资源是每个公民应尽的责任和义务。下列防止水污染的措施可行的是_____________。
A.抑制水中所有动植物生长 B.不任意排放工业废水
C.禁止使用农药和化肥 D.生活污水处理后再排放
②我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,制取 ClO2反应为:X + 2NaClO2 = 2ClO2+ 2NaCl,则 X 的化学式为_____________。
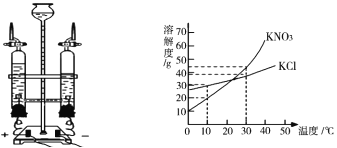
图 1 图 2
(2) 水的组成
电解水实验装置如图 1 所示,可用_____________检验与正极相连玻璃管内产生的气体,写出电解水的化学方程式_______________________________________。
(3) 水的用途
①将下列物质加入足量的水中,能形成无色溶液的是_____________(填字母)。
A. 植物油 B. 蔗糖 C. 碳酸钙 D. 高锰酸钾
②农业生产中,用质量分数为 7.1%的 KNO3溶液作为无土栽培的营养液,欲配制 200g 该营养液,需水
_____________ mL(水的密度近似看作 1g/cm3)。
③KCl 和 KNO3溶解度曲线如图 2 所示, 30℃时取 KNO3 12.5g,用 50g 水充分溶解,再将溶液降温到 10℃,此时 KNO3 溶液的质量是_____________ g。30℃时, KNO3 饱和溶液的溶质质量分数与 KCl 饱和溶液的溶质质量分数相比,前者与后者的关系是_____________(填字母) 。
A.大于 B.小于 C.等于 D.无法确定
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是自来水消毒过程中发生反应的微观示意图,下列说法正确的是( )
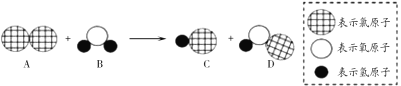
A. 该反应属于置换反应 B. 参加反应的 A、 B 两物质质量比为 1:1
C. 该反应的两种生成物都属于氧化物 D. 反应前后氯元素的化合价发生了改变
相关试题

