【题目】水的作用不可忽视.如图中五个实验分别用到水.
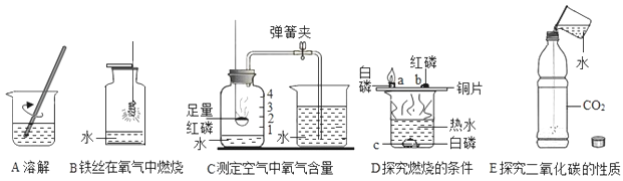
请回答下列问题:
(1)实验A中水作________(填“溶剂”或“溶质”),玻璃棒的作用________;
(2)实验B中反应的化学方程式为________,集气瓶中水的作用是________;
(3)实验C中反应的化学方程式是________,烧杯中的水进入集气瓶中的原理是________;
(4)实验D中水的作用是提供热量和________;
(5)用化学方程式表示实验E中水的作用________.
参考答案:
【答案】溶剂搅拌,加速溶解3Fe+2O2![]() Fe3O4防止高温熔融物炸裂集气瓶底部4P+5O2
Fe3O4防止高温熔融物炸裂集气瓶底部4P+5O2![]() 2P2O5红磷燃烧消耗集气瓶中的氧气,装置内气压减小,大气压把水压入集气瓶中约占集气瓶内气体体积的五分之一隔绝空气CO2+H2O=H2CO3
2P2O5红磷燃烧消耗集气瓶中的氧气,装置内气压减小,大气压把水压入集气瓶中约占集气瓶内气体体积的五分之一隔绝空气CO2+H2O=H2CO3
【解析】
(1)在溶液中只要有水,水一定作溶剂;溶解过程中玻璃棒有搅拌,加速溶解的作用;
(2)铁丝在氧气中燃烧生成四氧化三铁;反应的方程式为:3Fe+2O2![]() Fe3O4;铁丝燃烧时集气瓶底部放少量的水是防止高温熔融物炸裂集气瓶底部;
Fe3O4;铁丝燃烧时集气瓶底部放少量的水是防止高温熔融物炸裂集气瓶底部;
(3)磷在氧气中燃烧生成五氧化二磷;反应的方程式为:4P+5O2![]() 2P2O5;由于红磷燃烧消耗集气瓶中的氧气,装置内气压减小,大气压把水压入集气瓶中约占集气瓶内气体体积的五分之一;
2P2O5;由于红磷燃烧消耗集气瓶中的氧气,装置内气压减小,大气压把水压入集气瓶中约占集气瓶内气体体积的五分之一;
(4)热水温度达到了白磷的着火点,能使铜片上的白磷燃烧,所以提供了热量,使水中白磷不能燃烧,是验证没有氧气是否能燃烧,所以水的作用是隔绝空气;
(5)二氧化碳与水反应生成碳酸,所以反应方程式为:CO2+H2O═H2CO3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小冰将215.2g硝酸银溶液倒入一定量铜粉中,充分反应后,过滤,得到200g只含一种溶质的滤液和43.2g固体,所得滤液中含溶质的质量分数是( )
A. 6.6% B. 9.4% C. 18.8% D. 22.3%
-
科目: 来源: 题型:
查看答案和解析>>【题目】t℃时,烧杯中盛有20g水。对其进行如下操作,分别得到t℃时溶液A和溶液B。
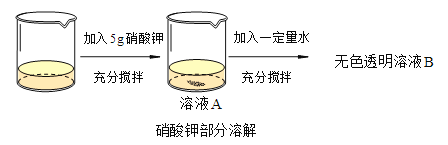
①上述溶液中溶质的化学式是_______________。
②充分搅拌使用的仪器名称是_______________。
③溶液A是__________(选填“饱和”或“不饱和”)溶液。
④要使部分硝酸钾固体全部溶解,还可以采用的方法为____________。
⑤t℃,未溶解的硝酸钾为1g,则该温度下,硝酸钾的溶解度为______g/100g水。
⑥请写出溶液A与溶液B的溶质质量分数的大小关系并分析理由___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
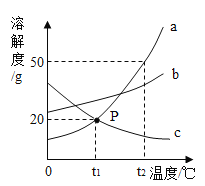
(1)P点的含义是________ .
(2)t2℃时30ga物质加入到50g水中不断搅拌,能形成80g溶液吗?________ (填写“能”或“不能”).
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是________ (填写物质序号).
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 ________ (填写选项序号).
A.c>a=b B.a=b>c C.a>b>c D.b>a>c.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示。
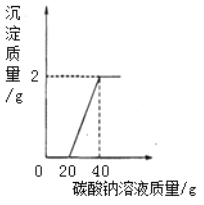
试回答:
(1)分析图中信息可知,20g废液中,所含的溶质是 (写化学式);
(2)在废液中加入碳酸钠溶液,首先与碳酸钠溶液反应的化学方程式为 ;
(3)计算废液中氯化钙的质量分数是多少?(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】“水是生命的载体”,水与人类生活和生产关系密切,请回答下列问题.
(1)①水能溶解很多物质,是配制溶液时最常用的________ .
②保持水的化学性质的最小粒子是________ .
(2)自然水经过处理可直接饮用.其处理步骤可用如图甲表示:
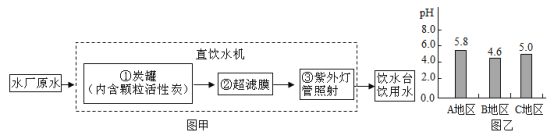
步骤①的作用是 ________.(填字母,下同),步骤③的作用是 ________.
A.杀菌消毒 B.吸附杂质
(3)降雨是自然界中水循环的一个环节.酸雨是由 ________、NO2气体或这些气体在空气中反应后的生成物溶于雨水所形成.A、B、C三个地区雨水的pH如图乙所示,其中 ________地区的雨水是酸雨.
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 _______.
(2)发生反应的化学方程式为________.
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(X)的比例式为________.
(4)该黄铜样品中铜的质量分数是________ .
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是 ________ .
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干.然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是_______,再经过某些反应操作就得到了所需铜盐.
相关试题

