【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)(1)、固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
(2)、氯化钙溶液和酒精溶液均呈中性。
(提出问题)固体酒精中的氢氧化钠是否变质?
(实验探究)
(1)、取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的_____,由此说明氢氧化钠已变质。
(2)、为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生_____ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_____。
他们另取烧杯中上层清液,加足量氯化钙溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)(1)、乙组实验中加足量氯化钙溶液的目的是_____。
(2)、乙组实验中能否用澄清石灰水代替氯化钙溶液_____(填“能”或“不能”)。
参考答案:
【答案】Na2CO3+CaCl2=CaCO3↓+2NaCl 白色沉淀 碳酸钠溶液显碱性,也能使酚酞试液变红色 检验并且除去碳酸钠 不能
【解析】
[实验探究]
1、取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,是因为碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
故填:Na2CO3+CaCl2=CaCO3↓+2NaCl。
2、滴加澄清石灰水,产生白色沉淀,是因为碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,实验过程如下所示:
实验方案 | ||
实验现象 | 溶液变红 | 产生白色沉淀 |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是碳酸钠溶液显碱性,也能使酚酞试液变红色。
故填:碳酸钠溶液显碱性,也能使酚酞试液变红色。
[反思交流]
1、乙组实验中加足量氯化钙溶液的目的是检验并且除去碳酸钠。
故填:检验并且除去碳酸钠。
2、乙组实验中不能用澄清石灰水代替氯化钙溶液,这是因为氢氧化钙和碳酸钠反应生成氢氧化钠,影响对氢氧化钠的检验。
故填:不能。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题:

(1)t2℃时,将30g的甲物质加入50g水中,充分溶解并恢复至原温度,所得溶液的质量为_____ g。
(2)当甲中混有少量乙,可采用_____方法提纯 甲物质。
(3)下列说法正确的是_____。
A 甲、乙两物质的溶解度相等;
B 氧气的溶解度随温度变化的规律与图中的丙相似;
C t2℃甲、乙、丙三种饱和溶液降温到t1℃,甲析出晶体的质量比乙多;
D t2 ℃等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的溶质质量分数大小:甲=乙>丙。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图中A、B、C、D、E、F分别表示初中化学常见的六种物质,B、C、D、E分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前提取量最大的金属,B由两种元素组成,C是大理石的主要成分。(图中用“﹣”表示两种物质之间能发生化学反应,用“→”或“
 ”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题。
”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题。
(1)写出F物质的化学式_____。
(2)写出C→E发生反应的化学方程式_____。
(3)B与D发生化学反应的基本类型是_____。
(4)写出少量A的粉末与过量的B发生反应的实验现象_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是实验室制取气体的常用装置,请回答相关问题:
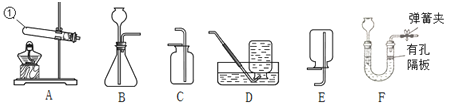
(1)写出仪器①的名称:_____。
(2)实验室用高锰酸钾制备并收集较纯净氧气应选用的装置是_____(填序号)。若用D装置收集氧气时,待集气瓶里的水排完后,接着_____,然后小心地把集气瓶移出水槽,正放在桌面上。
(3)装置B作为气体发生装置对反应物状态和反应条件的要求是_____;用装置C来收集CO2,其验满的方法是_____。 若用装置F制备CO2,其优点是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小英同学用某铁合金样品做了如下实验:称量11.4g样品,放入烧杯中,再往烧杯中加入189.2g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称得烧杯内物质总质量为200.2g。试计算(写出计算过程):
(1)反应产生氢气的质量_____。
(2)反应后所得溶液中溶质的质量分数_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】量取8mL水稀释浓硫酸的下列操作正确的是( )
A. 向10mL量筒中加水接近8mL

B. 再用滴管滴水至8mL

C. 把水加入浓硫酸中
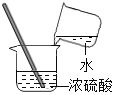
D. 搅拌
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关叙述、对应的方程式,所属基本反应类型都正确的是( )
A. 工业炼铁:3C+2Fe2O3
 4Fe+3CO2↑ 置换反应
4Fe+3CO2↑ 置换反应B. 实验室用稀硝酸与锌粒反应制取氢气:Zn+2HNO3=Zn(NO3)2+H2↑ 置换反应
C. 洗去试管上附着的铜:Cu+H2SO4=CuSO4+H2↑ 置换反应
D. 铝制品抗腐蚀:4Al+3O2
 2Al2O3 化合反应
2Al2O3 化合反应
相关试题

