【题目】我国拥有丰富的海洋资源,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的产品。
(1)海水晒盐是利用了_____的方法使食盐晶体析出,得到粗盐。
(2)某制碱工厂以粗盐为原料制纯碱,部分工艺流程如下: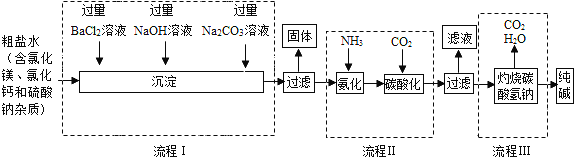
①流程I中为了除去杂质,依次加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,下列说法正确的是_____(填字母编号);
A.加入三种溶液的顺序不能调整
B.加入三种溶液可将粗盐水中的SO4、Mg2+、Ca2+转化为沉淀
C.按流程I所加溶液的顺序除杂,过滤后得到四种沉淀
②在流程I中,加入氢氧化钠溶液时发生反应的化学方程式是_____;
③流程I中Na2CO3溶液的作用是_____;
④写出流程Ⅲ中发生反应的化学方程式_____。
(3)将已配制好的100g质量分数为6%的氧化钠溶液变成质量分数为20%的氯化钠溶液,需要再加入NaCl的质量是_____g。
参考答案:
【答案】 (1)蒸发结晶; (2)BC; (3)MgCl2+2NaOH═Mg(OH)2↓+2NaCl; (4)去除溶液中的氯化钙和过量的氯化钡; (5)2NaHCO3![]() Na2CO3+H2O+CO2↑; (6)17.5;
Na2CO3+H2O+CO2↑; (6)17.5;
【解析】(1)由于氯化钠的溶解度受温度的影响不大,所以海水晒盐是利用了蒸发的方法使食盐晶体析出,得到粗盐;(2)①A、加入的三种溶液中,碳酸钠溶液必须在最后,而氯化钡溶液和氢氧化钠溶液可以颠倒顺序,该选项说法不正确;B、加入三种溶液将粗盐水中的SO42-、Mg2+、Ca2+转化为沉淀,该选项说法正确;C、按流程I所加溶液的顺序除杂,过滤后得到四种沉淀,即硫酸钡沉淀、氢氧化镁沉淀、碳酸钙沉淀和碳酸钡沉淀,该选项说法正确;②在流程I中,加入氢氧化钠溶液能与氯化镁反应生成了氢氧化镁沉淀和氯化钠,发生反应的化学方程式是:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;③由于溶液中含有氯化钙和过量的氯化钡,都能与碳酸钠反应,所以流程I中Na2CO3溶液的作用是:去除溶液中的氯化钙和过量的氯化钡;④流程Ⅲ中碳酸氢钠受热分解,发生反应的化学方程式是:2NaHCO3![]() Na2CO3+H2O+CO2↑;(3)设加入的氯化钠的质量为x,
Na2CO3+H2O+CO2↑;(3)设加入的氯化钠的质量为x, ![]() ×100%=20%,x=17.5g。
×100%=20%,x=17.5g。
-
科目: 来源: 题型:
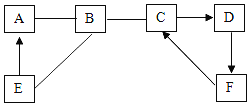
查看答案和解析>>【题目】A~F 是初中化学常见的六种物质,A、B、C、D属于不同类别的物质,A是一种单质,C可用于配制农药波尔多液,E为红棕色固体且与固体F属于同类物质。它们之间的转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质;反应条件、部分反应物和生成物已略去)。
(1)写出相应物质的化学式:A_____;F_____。(2)写出B与E反应的化学方程式_____;
(3)写出C转化为D的化学方程式_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属在生活、生产中有着非常广泛的应用。请回答下列问题:
(1)2017年8月21日,“复兴号”中国标准动车组开跑京津城际,车体是铝合金制成,铝合金是_____ (填字母编号)。
A.有机合成材料 B.金属材料 C.复合材料
(2)十八世纪,化学家们研究发现某些金属与某些物质反应能生成一种气体,该气体被喻为“会制造水的物质”,对上述反应原理的认识加快了推翻燃素学说的进程。该气体在空气中燃烧制造水的化学方程式是_____。
(3)金属R不在初中学到的金属活动性顺序表中,已知R的活动性位于铜、铝之间,某同学为了验证这三种金属的活动性顺序,他选择了打磨过的金属R,你认为他还需要选择的另外两种溶液是_____溶液和________溶液。
(4)工业上常用铝土矿炼制铝,其主要成分为氧化铝,现用200t含氧化铝51%的铝土矿(其他成分不含铝)炼铝,假设在炼制过程中铝元素共计损失了10%,则反应后可制得铝_____t。
(5)铜与另一种金属M的混合物(M可能是铝、铁或银),在该混合物中加入足量的稀硫酸有气泡产生,待反应完成后过滤,得到铜和滤液,在滤液中加入锌片,其表面有一层黑色物质,则M是_____;取一定量的原混合物投入到一定量的硝酸银溶液中,充分反应后,对反应所得溶液和固体推断正确的是_____ (填字母编号)。
A.所得溶液中一定有M的离子 B.固体中一定有银和铜
C.固体中一定有银 D.所得溶液中一定有硝酸银
-
科目: 来源: 题型:
查看答案和解析>>【题目】我区某校的实验考核题目之一为实验室制取气体。请根据装置回答下列问题:
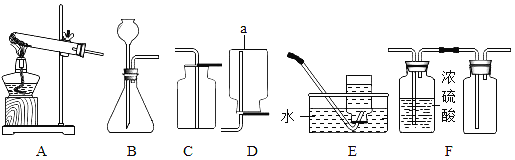
(1)写出图中仪器a的名称:_____。
(2)实验室用加热氯酸钾和二氧化锰混合物的方法制取并收集较纯净氧气时,应选用的装置为_____ (填字母,在A~E中选取),反应的化学方程式为_____;
(3)实验室用石灰石和稀盐酸制取并收集二氧化碳,应选择的装置为_____。(填字母,在A~E中选取);
(4)若用F装置收集一瓶干燥的某气体,则该气体可能是_____(填字母序号)
A.NH3 B.H2 C.O2 D.CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】24g某氯化钡样品中含有少量的氯化钠,某同学进行了如图所示的实验。请计算:
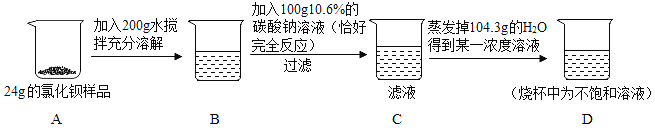
(1)原样品中氯化钡的质量分数__________(计算结果精确到0.1%);
(2)D烧杯中所得溶液的溶质质量分数_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学实验中能达到预期实验结果的是
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
-
科目: 来源: 题型:
查看答案和解析>>【题目】25℃时,向20.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是

A.b、d点对应溶液的pH:b>d
B.所用氢氧化钠溶液的质量分数一定为30%
C.向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D.d点对应的溶液中溶质是NaCl和NaOH
相关试题

