【题目】下列化学实验中能达到预期实验结果的是
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
参考答案:
【答案】A
【解析】试题分析:A、用计算的方法测定质量分数,可以根据计算的结果按照要求保留相应位数的小数,故选项实验能达到预期目的;B、pH试纸上的标准比色卡上的数字只有整数,即使用pH试纸所测得的溶液酸碱度为整数,故选项实验不能达到预期目的;C、氢氧化钙为微溶性物质,意味着20℃时氢氧化钙的溶解度在0.01g﹣1g之间,最大的质量分数=![]() ×100%<1%,选项实验不能达到预期目的;D、盐酸加热蒸发水时随着水分的蒸发会挥发出氯化氢气体,所以溶质质量分数会小于20%,故选项实验不能达到预期目的。故选:A。
×100%<1%,选项实验不能达到预期目的;D、盐酸加热蒸发水时随着水分的蒸发会挥发出氯化氢气体,所以溶质质量分数会小于20%,故选项实验不能达到预期目的。故选:A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与_________________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤
设计这一步骤的目的
实验现象
实验结论
1.将NaOH溶液加热煮沸
溶液变红,过一会儿红色消失
甲同学猜想_______(填“正确”或不正确”)
2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:________________________。甲同学认为乙同学的实验不够严谨,理由是__________________________________________________。

[注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分。]
(3)丙同学使用了色度传感器测溶液的颜色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH1溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。请你观察下图回答问题。
①写出两条规律性结论:_____________________;____________________。

②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为( )
A.小于30s
B.30-90s
C.90-140s
D.140-180s
E.180-280s
F.大于280s
-
科目: 来源: 题型:
查看答案和解析>>【题目】小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3.出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体.
【提出问题】白色固体是什么?
【作出猜想】
猜想Ⅰ:只有Na2CO3;
猜想Ⅱ:可能是Na2CO3和NaOH的混合物;
猜想Ⅲ: _________
【査阅资料】
(1)碳酸氢钠不稳定受热易分解2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O(2)Na2CO3与NaOH的热稳定性较好
(3)CaCl2和NaCl的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想 _________ 错误;若固体质量减少,则二氧化碳与氢氧化钠反应后, _________ 过量.
【交流讨论】
小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行? _________ ;理由是 _________ .
【继续探究】白色固体中是否有氢氧化钠?
实验操作
实验现象
目的/结论
①取白色固体适量配制成溶液.往所得溶液中滴加过量的 _________ ,充分反应后,过滤.
有白色沉淀生成
除去白色固体中的
_________
②取滤液,往滤液中滴入几滴 _________
_________
白色固体中没有氢氧化钠
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 _________ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】煤的综合利用是将煤隔绝空气加强热,使煤分解成许多有用的物质,煤气是其中一种。煤气的主要成分是什么呢?某兴趣小组为此展开了探究。
【查阅资料】(1)煤气中可能含有 CO、CO2、H2、CH4 中的一种或几种。
(2)常温下,氯化钯(PdCl2)溶液吸收 CO 时发生的化学反应方程式为:
CO +PdCl2+H2O
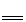 CO2+Pd↓(灰色) +2HCl
CO2+Pd↓(灰色) +2HCl【实验方案】兴趣小组的同学设计如下装置探究煤气中的成分。
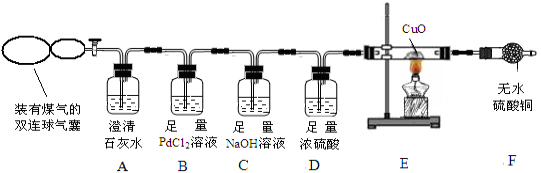
【交流讨论】请回答实验中的有关问题:
(1)实验开始后,A 中无明显现象,说明煤气中不存在____________________;
(2)若煤气中有 CO 存在,则 B中产生的现象是 ;
(3)写出 C 中发生反应的化学方程式__________________________(写一个即可);
D 中浓硫酸的作用是_________________________。
(4)若 F 中无水CuSO4变蓝色,则E中一定发生的化学方程式为 ;
(5)点燃F装置导出的气体,有火焰产生。江枫认为煤气中含 CH4,理由是CH4可以燃烧,CH4燃烧的化学方程式是___________________,老师则认为不能确认煤气中含有 CH4,理由是______________________。为了确定煤气中是否有CH4,老师接着采取的操作方法是 ;观察到的现象是___________________________________。由此验证煤气中一定含有CH4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】日常生活中发生的下列变化,属于化学变化的是
A.玻璃杯爆裂 B.植物光合作用
C.湿衣服晒干 D.酒精挥发
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的性质决定用途。下列因果关系不成立的是
A.因为氧气能支持燃烧,所以可能作燃料
B.因为氮气化学性质不活泼,所以可用于食品包装袋内防腐
C.因为磷燃烧能产生大量白烟,所以可用于制作烟幕弹
D.因为一氧化碳具有还原性,所以工业上用于炼铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于物质性质及用途的描述中错误的是
A.石墨能导电,可作电极
B.干冰气化吸热,可用于保藏食品
C.氧气有助燃性,可用于炼钢和气焊
D.稀有气体性质稳定,可制成霓虹灯
相关试题

