【题目】某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
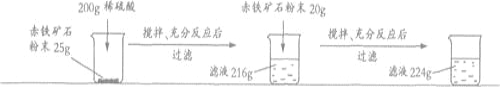
请回答下列问题:
(1)样品中Fe2O3的质量分数是_______;
(2)根据已知条件列出求解200g稀硫酸中溶质质量(x)的比例式___________________;
(3)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为_________;
(4)该钢铁厂每天用上述赤铁矿石1900t来生产生铁。则理论上日产含杂质5%的生铁的质量为_________。
参考答案:
【答案】64% ![]() =
=![]() 25%896t
25%896t
【解析】
(1)解:由题意可知,氧化铁与硫酸反应后溶液增加的质量就是参加反应的氧化铁的质量,加入25g铁矿石后溶液增加的质量=216g-200g=16g
样品中Fe2O3的质量分数=![]() ×100%=64%
×100%=64%
故填64%
(2)解:参加反应的氧化铁的质量=224g-200g=24g
设200g稀硫酸中硫酸的质量为x,生成硫酸铁的质量为y

![]() =
=![]()
![]() =
=![]()
解得 x=44.1g y=60g
故求解200g稀硫酸中溶质质量(x)的比例式为![]() =
=![]() 。
。
(3)解:由(2)知生成硫酸铁的质量为60 g,加入16g水后所得不饱和溶液中溶质的质量分数为
![]() ×100%=25%
×100%=25%
故填25%。
(4)解:日产含杂质5%的生铁的质量为
1900t×![]() ×100%×
×100%×![]() =896t
=896t
故填896t。
-
科目: 来源: 题型:
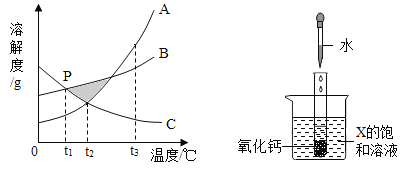
查看答案和解析>>【题目】已知A、B、C三种物质的溶解度曲线如图所示。
(1)在阴影区域部分,处于不饱和状态的是__________(选填“A、B盐酸反应生成、C”)。
(2)若饱和A溶液中含有少量的C,提纯A的方法为______结晶,过滤。
(3)P点表示的含义为_________。
(4)在t1℃下,B、C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为_______。
(5)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
-
科目: 来源: 题型:
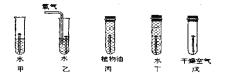
查看答案和解析>>【题目】学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。
下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,发现甲、乙、戊中铁钉生锈快慢的顺序为______________,通过这五个实验可以得出的结论是:_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4
 CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
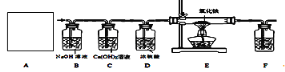
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
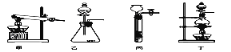
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
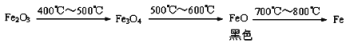
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量
玻璃管及其中固体的质量
装置F及其中物质的总质量
反应前
28.20 g
33.00 g
300.0 g
反应后
32.84 g
300.4 g
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应之间、化学物质之间具有包含、并列、交叉等关系。下表中X、Y符合下图所示关系的是( )
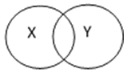
A
B
C
D
X
化合反应
化合反应
纯净物
燃烧
Y
氧化反应
分解反应
混合物
氧化反应
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置,回答相关问题。

(1)写出标号的仪器名称:①_________②__________
(2)用氯酸钾和二氧化锰制取比较干燥的氧气应选择的装置组合为________(填序号),写出该反应的文字或符号表达式___________________;实验时试管口略向下倾斜的原因是_______________________________________,检验氧气是否收集满的方法是_______________________________________________。
(3)实验室用高锰酸钾制取氧气,其文字或符号表达式是__________________________;在选用排水法收集氧气,导管口刚有气泡放出时,不宜立即收集,其原因是_________________________________;实验结束后,发现水槽中的水变红了,可能原因是:_______________________________________________________________。
(4)实验室用过氧化氢溶液和二氧化锰来制取氧气,其发生装置是_____(填字母),若用F装置(瓶中装满水)收集生成的氧气,气体应从_____(选填“a”或“b”)端导入。
(5)小王同学利用右图装置制取氧气并测定其密度。

实验中测得的数据有:加热前试管和固体混合物的总质量(M克),最后量筒内增加水的体积(V毫升),为达到实验目的还需测定的数据是____________(填序号)。
A.量筒内水的质量(M1克)
B.反应完后试管内剩余固体的质量(M2克)
C.反应完后试管及管内剩余固体的总质量(M3克)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B……H八种物质,有下图所示关系:其中A是一种暗紫色固体,B是黑色固体,E、F常温下都是一种无色的液体,D能使带火星的木条复燃,在②的反应前后B的质量和化学性质都不改变;G 在D中燃烧火星四射,生成一种黑色固体H。
试推断:
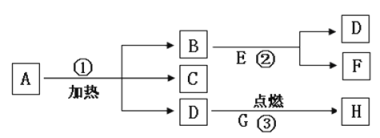
(1)写出下列物质的名称或符号:
A___________B____________E_____________
(2)写出D和G反应生成H的文字或符号表达式并在括号中注明反应的基本类型:___________________________(_________)
相关试题

