【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:___________________________;
(2)实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 ![]() CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
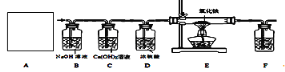
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的_________(填装置编号);
(2)图中装置C、D的作用分别是 ____________、_______________;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的_____________(填试剂名称),反应的化学方程式为 ______________________;
(4)该装置设计有一个明显缺陷,你认为是______________________________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②_________ ③ ____________。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,纯净的Fe2O3固体质量为_____________g,请选择有效的数据,推断出反应后黑色固体的成分(写出计算过程)__________________________。
根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:__________________________。
参考答案:
【答案】Fe2O3+3CO![]() 2Fe+3CO2丁证明CO2是否已经除尽吸收水分(或干燥CO)澄清的石灰水(或氢氧化钙溶液)CO2+Ca(OH)2═CaCO3↓+H2O;缺少尾气处理装置FeOFe3O4和FeO4.80Fe3O4CO+3Fe2O3
2Fe+3CO2丁证明CO2是否已经除尽吸收水分(或干燥CO)澄清的石灰水(或氢氧化钙溶液)CO2+Ca(OH)2═CaCO3↓+H2O;缺少尾气处理装置FeOFe3O4和FeO4.80Fe3O4CO+3Fe2O3![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
(1)炼铁的原理是氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,故化学方程式写为Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)固体草酸和浓硫酸制取CO是固液加热制取气体,发生装置选择固液加热的发生装置,故填丁;
(3)B装置用来除去二氧化碳,C装置用来检验二氧化碳是否除尽,证明CO2是否已经除尽故填;
(4)D中浓硫酸具有吸水性,可以干燥气体,故填吸收水分(或干燥CO);
(5)化学上用澄清的石灰水来检验二氧化碳,故填澄清的石灰水(或氢氧化钙溶液);
(6)石灰水中的氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,故反应的化学方程式写为Ca(OH)2+CO2═CaCO3↓+H2O;
(7)尾气中有残留的一氧化碳,直接排放会污染空气,装置中缺少尾气处理装置,故填缺少尾气处理装置;
(8)黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生,说明没有铁生成,则黑色固体只能是Fe3O4和FeO,故②填FeO③填Fe3O4和FeO;
(9)纯净的Fe2O3固体质量为=33.00 g-28.20 g=4.80 g,故填4.80。
(10)解:纯净的Fe2O3固体中铁元素的质量=4.80g×![]() 100%=3.36 g
100%=3.36 g
氧元素的质量=4.80g-3.36g=1.44 g
反应后损失的氧元素的质量=33.00g-32.84g=0.16g
反应后黑色固体中氧元素的质量=1.44g-0.16g=1.28g
设反应后黑色固体的化学式为FexOy
铁元素质量:氧元素质量=56x:16y=3.36g:1.28g
x:y=3:4
所以剩余黑色固体的成分的化学式为Fe3O4
故填Fe3O4;
(11)综合以上可知,氧化铁和一氧化碳在加热条件下反应生成四氧化铁和二氧化碳,故化学方程式写为CO+3Fe2O3 ![]() 2Fe3O4+CO2。
2Fe3O4+CO2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组利用图1所给仪器配制一定溶质质量分数的氯化钠溶液。
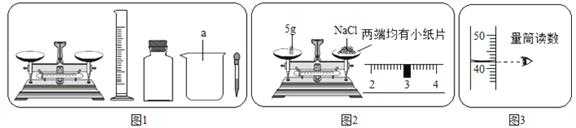
(1)图1中缺少一种必须用到的玻璃仪器是_________。
(2)图2中的操作错误是______________,若按图2操作,称量的氯化钠的实际质量是______。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质质量分数为(水的密度为1/cm3)_____________ 。
(4)该实验小组按照上述操作完成实验,则配制溶液的实际溶质质量分数是____________。(保留一位小数)
-
科目: 来源: 题型:
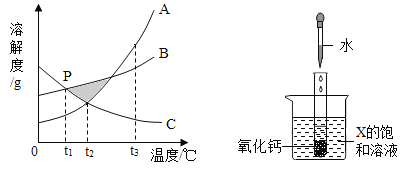
查看答案和解析>>【题目】已知A、B、C三种物质的溶解度曲线如图所示。
(1)在阴影区域部分,处于不饱和状态的是__________(选填“A、B盐酸反应生成、C”)。
(2)若饱和A溶液中含有少量的C,提纯A的方法为______结晶,过滤。
(3)P点表示的含义为_________。
(4)在t1℃下,B、C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为_______。
(5)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。
下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,发现甲、乙、戊中铁钉生锈快慢的顺序为______________,通过这五个实验可以得出的结论是:_______________。
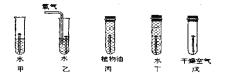
-
科目: 来源: 题型:
查看答案和解析>>【题目】某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
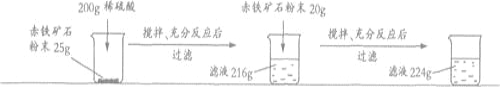
请回答下列问题:
(1)样品中Fe2O3的质量分数是_______;
(2)根据已知条件列出求解200g稀硫酸中溶质质量(x)的比例式___________________;
(3)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为_________;
(4)该钢铁厂每天用上述赤铁矿石1900t来生产生铁。则理论上日产含杂质5%的生铁的质量为_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应之间、化学物质之间具有包含、并列、交叉等关系。下表中X、Y符合下图所示关系的是( )
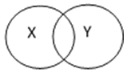
A
B
C
D
X
化合反应
化合反应
纯净物
燃烧
Y
氧化反应
分解反应
混合物
氧化反应
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置,回答相关问题。

(1)写出标号的仪器名称:①_________②__________
(2)用氯酸钾和二氧化锰制取比较干燥的氧气应选择的装置组合为________(填序号),写出该反应的文字或符号表达式___________________;实验时试管口略向下倾斜的原因是_______________________________________,检验氧气是否收集满的方法是_______________________________________________。
(3)实验室用高锰酸钾制取氧气,其文字或符号表达式是__________________________;在选用排水法收集氧气,导管口刚有气泡放出时,不宜立即收集,其原因是_________________________________;实验结束后,发现水槽中的水变红了,可能原因是:_______________________________________________________________。
(4)实验室用过氧化氢溶液和二氧化锰来制取氧气,其发生装置是_____(填字母),若用F装置(瓶中装满水)收集生成的氧气,气体应从_____(选填“a”或“b”)端导入。
(5)小王同学利用右图装置制取氧气并测定其密度。

实验中测得的数据有:加热前试管和固体混合物的总质量(M克),最后量筒内增加水的体积(V毫升),为达到实验目的还需测定的数据是____________(填序号)。
A.量筒内水的质量(M1克)
B.反应完后试管内剩余固体的质量(M2克)
C.反应完后试管及管内剩余固体的总质量(M3克)。
相关试题

