【题目】水是重要的自然资源。
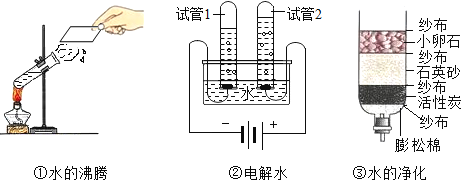
(1)关于水的认识不正确的是(填序号)______.
A. 自然界的水是纯净物B. 自然界的水是取之不尽,用之不竭的
C. 地球上的总水储量很大,但淡水资源并不充裕D. 工业废水和生活污水的任意排放会造成水体污染
(2)天然水中含有许多杂质,将天然水变成纯水的方法是______.
(3)若用过滤的方法在实验室净化一杯浑浊的河水,必须要使用的玻璃仪器有:烧杯、玻璃棒和______,其中玻璃棒的作用是______.
(4)如图所示的3个实验中,发生物理变化的是______(填序号).实验②中试管1所收集的气体为______(填化学式),此实验说明水是由______组成的。实验③中小卵石和石英砂的作用是______,活性炭的作用是______.
参考答案:
【答案】AB 蒸馏 漏斗 引流 ①③ H2 氢元素、氧元素 过滤 吸附
【解析】
(1)A、自然界中的水都不是纯水含有其他物质属混合物;A说法不正确;B、自然界的水资源是有限,B说法不正确;C、地球上储水量很大但淡水资源缺乏,C说法正确;D污水不能直接排放,要处理后才能排放,D说法正确;故答案为AB;
(2)在净水方法中只有蒸馏能得到纯水;
(3)过滤要用到的玻璃仪器有:烧杯、漏斗、玻璃棒,过滤时要用玻璃棒引流液体;
(4)水的沸腾和水的过滤过程都没有新物质生成属物理变化;电解水生成氢气和氧气,有新物质生成属化学变化,电解水时正极产生氧气,负极产生氢气,化学式为H2,由此说明水是由氢元素和氧元素组成的;活性炭具有吸附作用,吸附异味和色素。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组同学对实验室制氧气的条件进行如下探究:
(a)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
①将3.0g氯酸钾和1.0g二氧化锰均匀混合加热;
②将xg氯酸钾和1.0g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
①中反应的化学方程式是__________________________;②中x的值应为_____。
(猜想)除二氧化锰,氧化铜外,Fe2O3也可以做氯酸钾分解的催化剂。
按下表进行实验:测定分解温度(分解温度越低,催化效果越好)
实验编号
实验药品
分解温度/℃
①
氯酸钾
580
②
氯酸钾、二氧化锰(质量比1∶1)
350
③
氯酸钾、氧化铜(质量比1∶1)
370
④
氯酸钾、Fe2O3(质量比1∶1)
390
由实验________与实验④对比,证明猜想合理。实验所用的三种金属氧化物,催化效果最好的是___。
(b)乙探究了影响过氧化氢溶液分解速率的某种因素。实验记录如下:
过氧化氢溶液的质量
过氧化氢的浓度
二氧化锰的质量
相同时间内产生VO2
①
50.0g
1%
0.1g
9mL
②
50.0g
2%
0.1g
16mL
③
50.0g
4%
0.1g
31mL
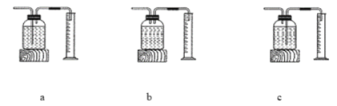
实验结论:在相同条件下,_______________________________,过氧化氢分解得越快。本实验中测量O2体积的装置(如图)应该选择:_______。(填字母)
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是五种粒子的结构示意图,下列说法错误的是( )

A.图中粒子共能表示四种元素
B.图中表示阴离子的是c、e
C.图中b粒子的化学符号为Mg2+
D.图中d粒子在化学反应中易失去电子
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~E为初中化学常见的物质,它们有如图所示的转化关系,图中“﹣”表示相连的物质间能相互发生反应,“→”表示物质间有相应的转化关系,其中A、B都是黑色固体,通常情况下,C是一种能使澄清石灰水变浑浊的气体,D是无色无味的液体,请回答下列问题:

(1)物质C的化学式是________;
(2)写出下列反应的化学方程式 ②__________其基本反应类型为 __________;
(3)写出由D转化为E的化学方程式____________该反应会____________(填“吸热”或“放热” )
-
科目: 来源: 题型:
查看答案和解析>>【题目】碘是紫黑色固体,可以溶解在无色透明的酒精中,形成紫红色的碘酒溶液。
(1)碘的元素符号是___;其颜色和___(填物质名称)的颜色一样。
(2)在生活中常用碘酒对皮肤上的伤口进行消毒,预防伤口发炎。消毒属于___变化。
(3)固体碘受热时升华为碘蒸气,此时碘分子本身没有发生变化,只是___发生变化,因而属于___变化。
(4)固体碘、碘蒸气、碘酒都能使无色的淀粉溶液变蓝,说明___.
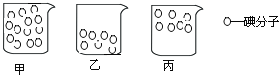
(5)甲、乙、丙三个同学分别画出下面的示意图,表示碘酒中碘分子的分布(酒精分子没有画出).
①如果乙同学的示意图符合事实,应该观察到的现象是___;
②根据你在实验中观察到的现象,___(填甲、乙、丙)的示意图符合事实。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验创新是中学生最为重要的科学素养,以下是化学兴趣小组的同学在学习“二氧化锰催化过氧化氢分解制氧气实验”后,对实验的创新设计。
实验一:设计新的实验装置
实验过程如下:
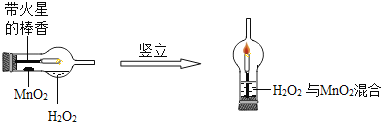
①将一支球形干燥管水平放置,用滴管吸取3mL(密度为1g/mL)质量分数为5%的H2O2加入干燥管的球泡中,再用药匙取0.2gMnO2粉末,加在干燥的进气管的管壁上;②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象;
(1)可观察到带火星的棒香立即___;
(2)下列各项是同学们对该创新实验的评价,你认为评价不合理的是___(填序号)
A. 实验所用的仪器、材料及药品均易得到
B. 实验室用的药品用量太大
C. 反应速度太慢,耽误时间
D. 实验现象明显,整个装置好似点燃的灯塔,趣味性强
实验二:寻找新的催化剂
(实验探究)
实验步骤
实验现象
I、分别量取5mL5%过氧化氢溶液放入A.B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A.B两支试管中插入带火星的木条,观察现象。
A试管中产生气泡,带火星木条复燃.B试管中无明显现象。
Ⅱ、待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。
试管中均产生气泡,带火星木条均复燃。
Ⅲ、将试验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥,称量。
所的固体质量为___
IV、分别量取5ml5%过氧化氢溶液放入C.D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。
(实验结论)
(1)A中产生的气体是___;
(2)实验Ⅱ、Ⅲ可以证明:___,再结合实验I和Ⅲ的结论可以证明氧化铁可以作为过氧化氢分解的催化剂。
(3)写出氧化铁(Fe2O3)催化过氧化氢分解的化学方程式:___________________;
(实验评价)
(1)设计实验IV的目的是___;
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是___.
(实验拓展)
查阅资料得知:CuO、CuSO4、猪肝、马铃薯等也可做过氧化氢溶液分解的催化剂,下列有关催化剂的说法正确的是___
A.MnO2只能作为过氧化氢溶液分解的催化剂
B. 同一个化学反应可以有多种催化剂
C. 催化剂能使原本不发生的反应也能快速进行
D. 用作催化剂的物质不可能是其它反应的反应物或生成物
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
(提供资料)① 二氧化碳与过氧化钠反应生成氧气和另一种物质。
② 碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。
③ 2Na2O2 + 2H2O= 4NaOH + O2↑。
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。同学们在老师的指导下设计了如下图所示装置。
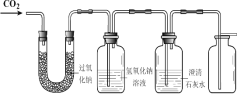
① 如何证明氧气已经收集满 ______。
② 氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到________ ,说明二氧化碳已经除尽。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
(猜想与假设)下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,你认为猜想_____是不正确的,理由是____。
(进行实验)同学们通过以下实验验证了另一种物质,请完成下述实验报告。
实验操作
实验现象
实验结论
取少量CO2与Na2O2反应后的固体于试管中,___________。
有大量气泡产生,澄清石灰水变浑浊。
猜想_____ 是正确的。
(反思与评价)若用人呼出的气体通过上图装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意这种做法,并阐述理由____ 。
相关试题

