【题目】某化学兴趣小组进行草酸亚铁晶体(FeC2O42H2O)分解的实验探究。
【猜 想】草酸亚铁晶体分解会产生CO、CO2和H2O三种气体。
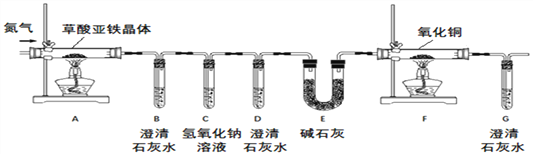
【实验方案】按照上图装置进行实验(夹持装置未画出)。
【问题讨论】(1)实验开始前需要先鼓入一段时间的N2,该操作的目的为_________;
(2)C中氢氧化钠溶液的作用是_______;
(3)E中碱石灰的作用是___________;
【结果分析】(4)定性分析:
①试管D中出现浑浊,证明产物中有_____存在;证明分解产物中存在CO的现象是_____。
②小明认为应增加H装置,则H装置应放在____两个装置之间,若观察到____,则证明有水生成;
(5)定量分析(假定每一步反应进行完全):取3.6g样品进行上述实验,测得装置A硬质玻璃管中残余1.44g黑色固体FeO,装置F中硬质玻璃管固体质量减轻0.32g,则草酸亚铁晶体(FeC2O42H2O)分解得到的CO2的质量为______。
【反思评价】(6)从环保角度考虑,该套实验装置的明显缺陷是______;
(7)文献显示,FeC2O42H2O受热分解时,固体的质量随温度变化的曲线如下图所示,写出加热到400oC时,FeC2O42H2O受热分解的化学方程式_______。
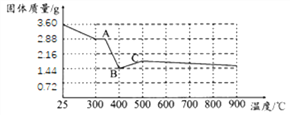
根据图像,若有3.6gFeC2O42H2O在敞口环境中充分加热,最终得到红棕色固体1.60g,则该物质的化学式为_______。由此,你认为进行该实验需要注意的事项是________________。
参考答案:
【答案】 排尽装置内的空气,防止空气中的CO2等对实验造成干扰 吸收CO2,防止对CO的检验形成干扰 吸收水蒸气(或干燥CO气体) CO2 D中石灰水不变浑浊,G中石灰水变浑浊(或黑色固体变红) AB 无水硫酸铜变蓝 0.88g 没有处理尾气 FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O↑ Fe2O3 FeC2O42H2O分解实验应在密闭环境中进行,因为FeO易被氧化等
FeO+CO↑+CO2↑+2H2O↑ Fe2O3 FeC2O42H2O分解实验应在密闭环境中进行,因为FeO易被氧化等
【解析】本题在草酸亚铁晶体(FeC2O42H2O)分解的实验探究的情境下考查了CO2、CO、H2O的检验,根据化学方程式的综合计算,综合较强,弄清每个装置的作用和反应曲线的涵义是解题的关键,化学计算中运用元素的守恒的观念。
(1) 空气中的CO2等对实验有干扰。实验开始前需要先鼓入一段时间的N2,该操作的目的为排尽装置内的空气,防止空气中的CO2等对实验造成干扰;
(2)CO是通过氧化铜的变色或澄清的石灰水变浑浊来检验的。C中氢氧化钠溶液的作用是吸收CO2,防止对CO的检验形成干扰;
(3)E中碱石灰的作用是吸收水蒸气(或干燥CO气体);
(4)①CO2能使澄清的石灰水变浑浊。试管D中出现浑浊,证明产物中有CO2存在;氧化铜与一氧化碳反应生成铜和二氧化碳,证明分解产物中存在CO的现象是D中石灰水不变浑浊,G中石灰水变浑浊(或黑色固体变红);
②小明认为应增加H装置,则H装置应放在AB两个装置之间,若观察到无水硫酸铜变蓝,则证明有水生成;
(5)根据化学方程式CuO +CO Δ Cu + CO2可知装置F中硬质玻璃管固体质量减轻的0.32g是参加反应的氧化铜中氧元素的质量。
设:参加反应的CO的质量为x
CuO +CO Δ Cu + CO2 Δm
28 16
X 0.32g
![]() x=0.56g
x=0.56g
3.6g的草酸亚铁晶体(FeC2O42H2O)中FeC2O4的质量=3.6g×![]() ×100%=2.88g,FeC2O4分解产生了FeO、CO、CO2,所以草酸亚铁晶体(FeC2O42H2O)分解得到的CO2的质量=2.88g-0.56g-1.44g=0.88g;
×100%=2.88g,FeC2O4分解产生了FeO、CO、CO2,所以草酸亚铁晶体(FeC2O42H2O)分解得到的CO2的质量=2.88g-0.56g-1.44g=0.88g;
(6)一氧化碳有毒,直接排放到空气中会污染空气。从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气;
(7) 加热到400oC时,FeC2O42H2O完全分解,化学方程式是FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O↑;
FeO+CO↑+CO2↑+2H2O↑;
设:1.44g的FeO中铁元素的质量=1.44g×![]() ×100%=1.12g, 根据质量守恒定律在化学变化中铁元素的质量不变,红棕色固体中氧元素的质量=1.60g-1.12g=0.48g,设:红色固体的化学式为FeaOb,则有56a:16b=1.12g:0.48g=2:3,所以红色固体的化学式为Fe2O3;氧化亚铁在空气中加热易生成氧化铁。该实验需要注意的事项是FeC2O42H2O分解实验应在密闭环境中进行,因为FeO易被氧化等。
×100%=1.12g, 根据质量守恒定律在化学变化中铁元素的质量不变,红棕色固体中氧元素的质量=1.60g-1.12g=0.48g,设:红色固体的化学式为FeaOb,则有56a:16b=1.12g:0.48g=2:3,所以红色固体的化学式为Fe2O3;氧化亚铁在空气中加热易生成氧化铁。该实验需要注意的事项是FeC2O42H2O分解实验应在密闭环境中进行,因为FeO易被氧化等。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学能帮助我们更好地认识生活、改善生活。
(1)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分
含量(每100 g)
营养成分
含量(每100 g)
水分
9.9 g
钙元素
23.00 mg
脂肪
0.2 g
铁元素
1.10 mg
蛋白质
4.8 g
硒元素
0.02 mg
淀粉
82.5 g
其他
……
① 紫薯中能为人体提供能量的营养物质为脂肪、淀粉和_______;
②以上营养成分中_____(填元素符号,下同)是人体中含有的微量元素,______摄入不足,会导致骨质疏松、佝偻病;
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(2)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的________性;
②高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于________(填字母);
a.金属材料 b.无机非金属材料 c.有机高分子材料
③高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是________(填字母);
a.铜 b.石墨 c.二氧化硅
④基础工程建设中常用到水泥、玻璃、钢材等。在钢材中添加铬、镍等元素的目的是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
【资料】(1)硝酸受热易分解,且硝酸具有挥发性;
(2)二氧化硅不溶于酸。

(1)Cu、CuO及Cu2O均能溶于稀硝酸。“酸溶”时加入过量的稀硝酸的目的是______。
(2)“酸溶”时,反应温度不宜超过70 ℃,其主要原因是_____________,若保持反应温度为70 ℃,欲加快反应速率还可采取的措施为_____。
(3)“中和”时,试剂A最好选用________________(填字母)。
a.Fe2O3 b.CaCO3 c.Cu(OH)2
(4) “过滤”时所需的玻璃仪器有烧杯、____________、玻璃棒,玻璃棒的作用是_____,所得废渣的主要成分的化学式为______________。
(5)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法:蒸发浓缩、________、过滤、冰水洗涤、低温烘干,采用冰水洗涤的目的是_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与科学、技术、社会、环境密切相关。
(1) 改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是_____________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是_____________。
a. 用熟石灰处理废水中的酸 b. 用铁粉回收废水中的铜
③ 下列做法会造成土壤重金属污染的是_____________。
a. 作物秸杆露天焚烧 b. 废干电池就地填埋 c. 废旧塑料随意丢弃
(2) 新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
① 属于人体所需微量元素的是_____________。
② 属于脂溶性维生素的是_____________。
③ 可为人体提供能量的是_____________、_____________和_____________。
(3)材料的发展与应用促进了人类社会的进步。“复兴号”高铁使用了大量新材料、新技术。
①“复兴号”车厢连接处关键部位特高压过桥线电缆的耐磨护板为增强聚四氟乙烯板。聚四氟乙烯属于_____________(填字母,下同)。

a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②“复兴号”上网速可达90兆,信息传输使用了光导纤维。光导纤维主要成分是_____________。
a. 石墨 b. 二氧化硅 c. 晶体硅
③“复兴号”车体不用钢材而用镁铝合金型材,是因为镁铝合金_____________。
a. 强度大 b. 密度小 c. 价格便宜
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类社会的发展离不开能源。当今社会,人类利用的能源主要来自化石燃料。
(1)化石燃料蕴藏的能量来源于生物体吸收的_____________; “可燃冰”又称天然气水合物,它是在海底的高压、低温条件下形成的,1体积“可燃冰”可储藏100~200体积的甲烷。下列关于“可燃冰”的叙述中,不正确的是_____________。
A.“可燃冰”不是冰 B.“可燃冰”有可能成为人类未来的重要能源
C.“可燃冰”的可燃成分是甲烷 D.“可燃冰”的实质是水变成的固态油
(2)用来驱动汽车、飞机和轮船的燃料主要是从石油中根据不同沸点范围分馏出来的汽油、航空煤油、柴油等,石油分馏的过程属_____________变化。石油中主要含有碳、氢元素,还含有硫、氮等元素,燃烧时会产生的污染物有_____________(写一种)。
(3)在实验室里,可用稀高锰酸钾溶液检验二氧化硫,现象是________________________;反应的化学方程式为:5SO2+2KMnO4+xH2O═K2SO4+2MnSO4+2H2SO4。其中x的值为_____________,恰好完全反应后,溶液中大量存在的阴离子是_____________(填符号)。
(4)开发和利用清洁高效而又用之不竭的新能源,是21世纪人类面临的重要课题。2006年1月起,我国部分地区推广使用乙醇汽油。乙醇可利用农作物发酵制得,农作物在催化剂作用下转化为葡萄糖(C6H12O6),然后葡萄糖在酒化酶的作用下分解为乙醇和二氧化碳,写出葡萄糖分解为乙醇的化学方程式_________。
(5)科学家用转基因的方法培育出一种“食电”细菌,它“吃进”电能,把二氧化碳和水转化为甲烷等物质,能量转化率高达80%,下列说法中正确的是_____________。
A.细菌“食电”过程能释放出氧气 B.上述反应属于化合反应
C.这种方法能缓解白色污染 D.“食电”细菌不属于生物
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

已知:①SiO2不溶于酸 ②Fe2(SO4)3 + Fe == 3FeSO4
回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是_______________。
(2)步骤Ⅱ中加入足量的铁粉目的是除去过量的酸,还可能有的作用是________________________。
(3)煅烧FeCO3生成产品I的化学反应方程式为______________________。
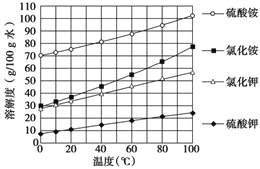
(4)已知几种盐的溶解度随温度变化的曲线如下图所示,产品Ⅱ的化学式为_____________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是蒸发浓缩、__________、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是________________________。
(6)步骤Ⅲ中可选用__________________(填序号)试剂调节溶液的pH。
A.稀硝酸 B.双氧水 C.氨水
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是我国颁布的生活饮用水水质标准的部分内容。
项目
标准
感官指标
无异味、异臭等
化学指标
pH 6.5~8.5,铜<1.0mgL-1,氟化物<1.0mgL-1,游离氯≥0.3mgL-1等
⑴感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的 pH=8时,表明自来水呈________ (填“酸性”、“碱性”或“中性”)。
⑵天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
⑶硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
⑷液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
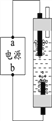
⑸饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_________。
⑹ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
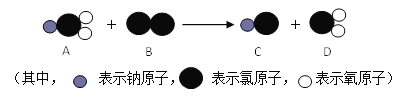
该反应的化学方程式是_________________。
相关试题

