【题目】图甲是实验室制取气体的装置图(固定装置省略),请回答下列问题:

(1)仪器名称:a_____,b_____.
(2)图甲B图的装置可用来制取一种具有助燃性的气体,写出制取该气体的化学方程式:_______,该装置操作上的优点是________.D装置操作上的优点是________________.
(3)若要制取大量的二氧化碳用于实验,宜选用_____(图A-C中选填)做发生装置,此装置的气密性检查方法是______________________。若用E收集一瓶干燥的二氧化碳,其中Ⅰ瓶中盛放的试剂是_____(填名称),并将图E补充完整.______________
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图乙所示.打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_____(填字母).
A.氢氧化钠溶液 B.碳酸钠溶液 C.硫酸钠溶液 D.澄清石灰水.
参考答案:
【答案】 锥形瓶 长颈漏斗 2H2O2 ![]() 2H2O+O2↑ 能控制反应速率 能控制反应的发生和停止 C 往长颈漏斗中加水至液封,如在漏斗中能形成一段稳定的水柱,则气密性好 浓硫酸
2H2O+O2↑ 能控制反应速率 能控制反应的发生和停止 C 往长颈漏斗中加水至液封,如在漏斗中能形成一段稳定的水柱,则气密性好 浓硫酸  C
C
【解析】根据所学知识可知(1)仪器a为锥形瓶;b为长颈漏斗;(2)装置B为固液常温下制备气体的装置,制得的气体有助燃性,则该气体为氧气,故制取该气体的化学方程式:2H2O2![]() 2H2O+O2↑,该装置操作上的优点是能控制液体的滴加速率进而控制反应速率;D装置当气体增多时,压强增大,将液体压出试管,使固体和液体分离,反应停止;反之,气体减少,压强变小,液面上升,固体和液体接触,反应开始;故操作上的优点是能控制反应的发生和停止;(3)若要制取大量的二氧化碳用于实验,宜选用C做发生装置,此装置的气密性检查方法是将导管连接的胶管加紧,然后往长颈漏斗中加水至液封,如在漏斗中能形成一段稳定的水柱,则气密性好。若用E收集一瓶干燥的二氧化碳,其中Ⅰ瓶中盛放的试剂是应是浓硫酸,二氧化碳从长管进,短管出;(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图乙所示.打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,可向长颈漏斗中添加不能与硫酸反应的试剂,氢氧化钠溶液 、碳酸钠溶液 、澄清石灰水都能和硫酸反应,不符合要求,所以应选择不与硫酸反应的硫酸钠。
2H2O+O2↑,该装置操作上的优点是能控制液体的滴加速率进而控制反应速率;D装置当气体增多时,压强增大,将液体压出试管,使固体和液体分离,反应停止;反之,气体减少,压强变小,液面上升,固体和液体接触,反应开始;故操作上的优点是能控制反应的发生和停止;(3)若要制取大量的二氧化碳用于实验,宜选用C做发生装置,此装置的气密性检查方法是将导管连接的胶管加紧,然后往长颈漏斗中加水至液封,如在漏斗中能形成一段稳定的水柱,则气密性好。若用E收集一瓶干燥的二氧化碳,其中Ⅰ瓶中盛放的试剂是应是浓硫酸,二氧化碳从长管进,短管出;(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图乙所示.打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,可向长颈漏斗中添加不能与硫酸反应的试剂,氢氧化钠溶液 、碳酸钠溶液 、澄清石灰水都能和硫酸反应,不符合要求,所以应选择不与硫酸反应的硫酸钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
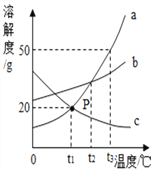
(1)三种物质的溶解度随着温度升高而减小的是_____。
(2)t2℃时,物质a的溶解度与物质_____的相等。
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_____溶液(填“饱和”或“不饱和”)。其溶液的溶质质量分数是___________(结果保留小数点后一位)。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是_____(填字母序号)。
A.a>b B.a=b C.a<b D.不能确定。
-
科目: 来源: 题型:
查看答案和解析>>【题目】框图中A是人体胃液中含有的成分,B用于改良酸性土壤,G是铁锈的主要成分(Fe2O3·xH2O),E、F、I为无色气体。根据图示回答下列问题。
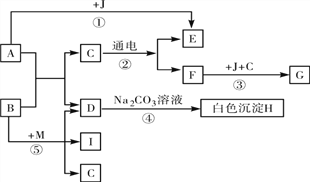
(1)写出有关物质的化学式:E_______,J________,
(2)写出有关反应的化学方程式:
反应①:______________________________;
反应④:______________________________;
反应⑤:______________________________;
(3)反应④属于 _______反应(填反应基本类型)。
(4)日常生活中为了阻止反应③发生,通常采取的措施是:___________________(写一条)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2),不考虑其它杂质)制取金属铝的基本流程如下:

已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质;
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
(1)操作Ⅱ的名称是__________ 。所用的玻璃仪器有烧杯、漏斗、_________(填仪器名称)。
(2)滤液Ⅱ中溶质的用途之一是________________ 。
(3)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是______(填化学式)。
(4)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于__________ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室开放日,化学小组的同学来到实验室,对酸的性质很感兴趣,向老师提出研究硝酸的性质,老师高兴答应并带领同学们进行了硝酸性质的实验探究。
(1)(实验设计)
①将石蕊试液滴入稀硝酸中,预计石蕊试液由紫色变________色。
②将Zn片投入稀硝酸中,预计将产生氢气。
(2)(实验验证)
同学们按上述设计做了实验,却发现石蕊变色后一会儿即褪去,Zn片投入稀HNO3后,溶液中冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B。
(提出问题)
①石蕊试液变色后为何会褪色?
②上述产生的无色气体是什么?硝酸具有哪些特性?
(查阅资料)
看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:
①硝酸可与Zn、Cu等多种金属反应生成相应的硝酸盐,但不生成H2。
②含氮元素的某些气态物质的物理性质:
NH3
N2
NO
NO2
颜色
无色
无色
无色
红棕色
溶解性
极易溶于水
不溶于水
不溶于水
可溶于水或硝酸
(猜想与分析)
小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是________。
(3)大家一致认同了红棕色气体B是NO2 , 但对于无色气体A及变化的原因有不同的看法:
①小丽同学认为A是NH3 , 但遭到了大家的一致反对,原是________。
②小强同学认为A是N2 , 也遭到大家的一致反对,原因是________。
③经讨论,最终大家获得了A是NO,NO在试管口遇氧气生成NO2的共识。
(4)(实验探究)
小红同学对硝酸与Cu反应很感兴趣,便取了一小块Cu片投入稀HNO3中,发现Cu片溶解,也出现了上述Zn与稀HNO3反应的类似现象,确认生成了NO,并在老师的帮助下,测出恰好反应的Cu和HNO3的化学计算量数之比为3:8,由此获得了Cu与稀HNO3的反应化学方程式________。
(5)(交流与反思)
①根据探究结果,请你解释稀HCl跟Cu不反应而稀HNO3却能跟Cu反应的原因________。
②实验室制取氢气________(填“能”“不能”)用稀硝酸。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变。可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃。己知某种可燃冰的化学式为:CH4·8H2O。请回答:
(1)这种可燃冰中含有______种元素:原子个数比:C:H:O=________;
(2)这种可燃冰中甲烷的质量分数为________%;936g(约1升)该可燃冰常温下可释放出____升甲烷(常温下甲烷密度为0.72g/L)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定某稀硫酸的溶质的质量分数,小兰同学设计了如下实验方案.

第②步实验中生成沉淀的质量与加入NaOH溶液的质量关系如图.
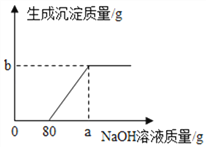
(1)分析第②步实验:与先加入的80g NaOH溶液反应的物质是_____(填化学式),继续加入NaOH溶液后产生的沉淀是_____(填名称)
(2)计算稀硫酸的溶质的质量分数______________(写出计算过程)
相关试题

