【题目】完成下列计算题:
(1)某元素R的原子能够形成核外有10个电子的Rn- 离子,则元素R的原子序数为_______。
(2)已知:十个C-12原子的质量为m克,一个氧原子的质量为n克,则该氧原子的相对原子质量为_______(用m、n表示)。
(3)已知某温度下,200g水中最多可溶解50gNaCl固体,则该温度下NaCl饱和溶液的溶质质量分数为_______。
参考答案:
【答案】10-n 120n/m 20%
【解析】
(1)根据当核电荷数=质子数=核外电子数=原子序数分析;
(2)相对原子质量是指以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比;
(3)根据溶质的质量分数的公式分析。
(1)某元素R的原子得到n个电子形成Rn- 离子,Rn- 离子核外有10个电子,说明元素R的原子的电子数为10-n,则元素R的原子序数为10-n;
(2)由某原子的相对原子质量=![]() ,该氧原子的相对原子质量为
,该氧原子的相对原子质量为![]() =
=![]() ;
;
(3)已知某温度下,200g水中最多可溶解50gNaCl固体,达到饱和,则该温度下NaCl饱和溶液的溶质质量分数为![]() ×100%=20%。
×100%=20%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A~F是初中化学常见的物质。A和C为液体,且组成A和C的元素种类相同;B和D为气体;蓝色絮状沉淀E加热分解生成黑色固体F。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
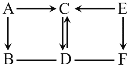
(1)写出化学式:A________,B________。
(2)写出化学方程式: D → C __________, E → F __________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组对氧气的制取进行了进一步探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当_________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验3次并记录数据。
②用排水法收集氧气:氧气能用排水法收集的原因是____,用传感器测定集气瓶中氧气的体积分数。重复该实验3次并记录数据。
氧气的收集方法
向上排空气法
排水法
氧气的体积分数/%
79.7
79.6
79.9
90.0
89.8
89.3
氧气的平均体积分数/%
79.7
89.7
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是__________。
(2)用过氧化氢溶液制氧气,探究不同催化剂催化过氧化氢分解的效果。
(查阅资料)
①MnO2、Cr2O3、Fe2O3、CuO、S对过氧化氢的分解均具有催化作用。
②海藻酸钠可以作为催化剂的载体支架,形成负载不同催化剂的海藻酸钠微球。
(进行实验)
①制备五种负载不同催化剂(MnO2、Cr2O3、Fe2O3、CuO、S)的海藻酸钠微球,每个微球大小相同,且负载催化剂的质量相等。
②取30粒负载某种催化剂的海藻酸钠微球与20mL质量分数为5%的过氧化氢溶液,在锥形瓶中迅速混合发生反应,实验装置如图1,采集200s内压强数据,绘制曲线如图2。

(实验分析)①每次实验时,海藻酸钠微球数应相同的原因是_________。
②本实验中,通过一段时间内______来反映生成氧气的快慢。
③本实验中,负载MnO2的微球显示了良好的催化效果,60s时竟将橡皮塞弹飞,在图2中对应的曲线是_______(填“a”或“b”);负载_______的微球催化效果较好,反应温和;负载Fe2O3、Cr2O3的微球催化效果一般;负载_______的微球催化能力最弱。
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列实验题
(实验一)结合净化黄泥水的活动经验和加工自来水的原理,指出下列杂质的除去方法(填方法名称)
水中杂质种类
除去杂质的方法名称
颗粒较大的不溶性杂质
____
颗粒较小的不溶性杂质
____
可溶性杂质
____
(实验二)实验室欲配制一定质量分数的食盐溶液。请完成下列问题:
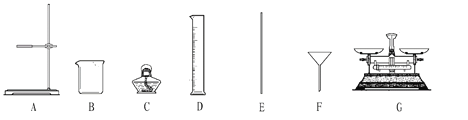
(1)B仪器的名称是_______,D仪器的名称是_____。
(2)完成本实验,所需仪器除B、E外,还必须选用上述仪器中的_______(填仪器编号),仪器E的作用是_______。
(3)配制的步骤可以概括为计算、称量和量取、_______、装瓶。
(4)如果量取水的体积时,操作者的视线是仰视,则所配溶液的质量分数将_______(填“偏大”或“偏小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表为元素周期表的一部分,请你根据表中信息回答下列问题:
①
He
②
③
④
⑤
⑥
⑦
⑧
Ne
⑨
⑩
Ar
Kr
(1)表中②号与⑥号元素在元素周期表中处于同一_______(填“周期”或“族”)。
(2)表中⑤号元素的元素名称为_____,表中⑥号元素的质子数为_______,⑨号元素的原子结构示意图为_____。
(3)表中⑩号元素在化学反应中容易_______(填“得到”或“失去”电子),⑦号元素的1个原子获得2个电子后所形成的微粒符号为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】仔细阅读下面的探究实验信息,回答相关问题。
Ⅰ.(实验目的)探究固体物质溶于水时的热现象。
Ⅱ.(查阅资料)
(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程。
(2)通常状况下,水的凝固点为0℃、沸点为100℃。
Ⅲ.(提出猜想)物质固体物质溶于水时,有可能出现放热、_____、既不放热也不吸热等三种可能性。
Ⅳ.(实验探究)某探究小组的同学设计了如下图所示的实验方案。试剂瓶a、b、c中分别盛装有A、B、C三种干燥的粉末状固体药品。操作:用a、b、c三个烧杯,分别盛装相同体积的水,将烧杯中的水加热至沸腾,撤去酒精灯,见沸腾刚止即迅速向a、b、c烧杯中对应加入一药匙的A、B、C。现象:a烧杯中的水立即沸腾,b、c烧杯中的水未见沸腾现象。
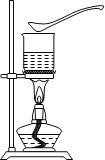



Ⅴ.(实验结论)
(1)物质A溶于水时,其热现象为_____,说明Q吸_______(填“>”或“<”或“=”)Q放。
(2)物质B或C溶于水时,其热现象为_______。
Ⅵ.(反思交流)不能准确断定物质B或C溶于水时的热现象的原因是_______。
Ⅶ.(拓展实验)小张同学对物质A溶于水的实验现象很感兴趣,继续向沸腾刚止的热水中加入相同质量的物质A,又看到沸腾现象,继续如此重复实验,至烧杯中出现固体物质后,再继续加入相同质量的物质A,却看不到沸腾现象。请解释不再产生沸腾现象的原因_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列计算:
(1)向200g30%的A物质的水溶液中加入100g60%的A物质的水溶液,充分混合,所得溶液的溶质质量分数为_______。
(2)欲配制密度为1.31g/mL、溶质质量分数为20%的KNO3溶液1000g,需要水_______g
相关试题

