【题目】仔细阅读下面的探究实验信息,回答相关问题。
Ⅰ.(实验目的)探究固体物质溶于水时的热现象。
Ⅱ.(查阅资料)
(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程。
(2)通常状况下,水的凝固点为0℃、沸点为100℃。
Ⅲ.(提出猜想)物质固体物质溶于水时,有可能出现放热、_____、既不放热也不吸热等三种可能性。
Ⅳ.(实验探究)某探究小组的同学设计了如下图所示的实验方案。试剂瓶a、b、c中分别盛装有A、B、C三种干燥的粉末状固体药品。操作:用a、b、c三个烧杯,分别盛装相同体积的水,将烧杯中的水加热至沸腾,撤去酒精灯,见沸腾刚止即迅速向a、b、c烧杯中对应加入一药匙的A、B、C。现象:a烧杯中的水立即沸腾,b、c烧杯中的水未见沸腾现象。
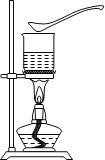
![]()
![]()
![]()
Ⅴ.(实验结论)
(1)物质A溶于水时,其热现象为_____,说明Q吸_______(填“>”或“<”或“=”)Q放。
(2)物质B或C溶于水时,其热现象为_______。
Ⅵ.(反思交流)不能准确断定物质B或C溶于水时的热现象的原因是_______。
Ⅶ.(拓展实验)小张同学对物质A溶于水的实验现象很感兴趣,继续向沸腾刚止的热水中加入相同质量的物质A,又看到沸腾现象,继续如此重复实验,至烧杯中出现固体物质后,再继续加入相同质量的物质A,却看不到沸腾现象。请解释不再产生沸腾现象的原因_____。
参考答案:
【答案】吸热 放热 < 吸热或既不放热也不吸热 沸腾刚止的水不再沸腾,不能说明物质溶液水时,溶液温度是降低还是未变 溶液已达饱和,不能再溶解物质A,不能再使溶液温度升高到100℃
【解析】
[提出猜想]根据物质固体物质溶于水时吸放热情况,有可能出现放热、吸热、既不放热也不吸热等三种可能性。
[实验结论](1)A物质溶于水,烧杯中的水立即沸腾,说明其溶于水放热;Q吸<Q放;
(2)BC物质溶于水,烧杯中的水未见沸腾现象,说明其溶于温度没有升高,物质B或C溶于水时,所以吸热或既不放热也不吸热;
[反思交流] 由于沸腾刚止的水不再沸腾,不能说明物质溶液水时,溶液温度是降低还是未变,所以不能准确断定物质B或C溶于水时的热现象;
[拓展实验]当溶液已达饱和,不能再溶解物质A,不能再使溶液温度升高到100℃,所以至烧杯中出现固体物质后,再继续加入相同质量的物质A,却看不到沸腾现象。
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列实验题
(实验一)结合净化黄泥水的活动经验和加工自来水的原理,指出下列杂质的除去方法(填方法名称)
水中杂质种类
除去杂质的方法名称
颗粒较大的不溶性杂质
____
颗粒较小的不溶性杂质
____
可溶性杂质
____
(实验二)实验室欲配制一定质量分数的食盐溶液。请完成下列问题:
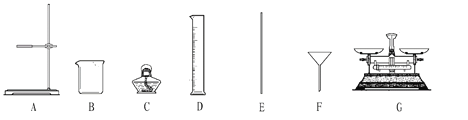
(1)B仪器的名称是_______,D仪器的名称是_____。
(2)完成本实验,所需仪器除B、E外,还必须选用上述仪器中的_______(填仪器编号),仪器E的作用是_______。
(3)配制的步骤可以概括为计算、称量和量取、_______、装瓶。
(4)如果量取水的体积时,操作者的视线是仰视,则所配溶液的质量分数将_______(填“偏大”或“偏小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列计算题:
(1)某元素R的原子能够形成核外有10个电子的Rn- 离子,则元素R的原子序数为_______。
(2)已知:十个C-12原子的质量为m克,一个氧原子的质量为n克,则该氧原子的相对原子质量为_______(用m、n表示)。
(3)已知某温度下,200g水中最多可溶解50gNaCl固体,则该温度下NaCl饱和溶液的溶质质量分数为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表为元素周期表的一部分,请你根据表中信息回答下列问题:
①
He
②
③
④
⑤
⑥
⑦
⑧
Ne
⑨
⑩
Ar
Kr
(1)表中②号与⑥号元素在元素周期表中处于同一_______(填“周期”或“族”)。
(2)表中⑤号元素的元素名称为_____,表中⑥号元素的质子数为_______,⑨号元素的原子结构示意图为_____。
(3)表中⑩号元素在化学反应中容易_______(填“得到”或“失去”电子),⑦号元素的1个原子获得2个电子后所形成的微粒符号为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列计算:
(1)向200g30%的A物质的水溶液中加入100g60%的A物质的水溶液,充分混合,所得溶液的溶质质量分数为_______。
(2)欲配制密度为1.31g/mL、溶质质量分数为20%的KNO3溶液1000g,需要水_______g
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
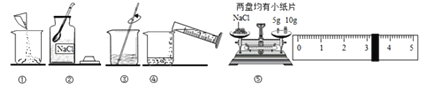
(1)用图中序号表示配制溶液的正确操作顺序 ;
(2)图②中用来取用NaCl的仪器是 ;
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示位置见图,则称取的NaCl质量为 g;
(4)NaCl称量完毕放回砝码时,发现10g的砝码有缺损,若其他操作步骤正确,则所配制溶液的质量分数 (填“大于”、“小于”或“等于”)10%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)下表是元素周期表的一部分,请你根据下表回答问题:
3 Li
锂
6.941
4Be[来铍
9.012
5 B
硼
10.81
6 C
碳
12.01
7 N
氮
14.01
8 O
氧
16.00
9 F
氟[来 19.00
10 Ne
氖
20.18
11 Na
钠
22.99
12 Mg
镁
24.31
13 Al
铝
26.98
14 Si
硅
28.09
15 P
磷
30.97
16 S
硫
32.06
17 Cl
氯
35.45
18 Ar
氩
29.95
(1)根据上表回答问题
①钠的相对原子质量是 。
②上表中,金属元素有 种。
(2)图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图。
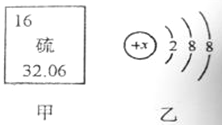
①该元素的原子的核电荷数为 ,该原子的最外层电子数为 。
②图乙所示粒子的符号为 。
相关试题

