【题目】对于学习中遇到的无现象一类的化学反应,应多多思考创设情境使现象外显,证明反应的发生。
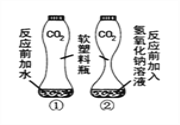
(1)对于反应:2NaOH + CO2 = Na2CO3 + H2O,若从反应物的消耗(二氧化碳的消耗)考虑证明反应的发生,可设计如右图实验,图①的作用是__________________,证明CO2 与NaOH溶液中的溶质确实发生了反应,现象是_________________;或从生成物的产生角度(检验碳酸钠)证明反应的发生,设计实验,方案是_______________(用简洁的文字简要叙述),现象是___________________,请写出该反应的化学方程式_______________________。
(2)对于反应:HCl+NaOH=NaCl+H2O,下列证明反应发生的方法可行的是_________。(可多选)
A.测定反应前后溶液的酸碱度 B.测定反应前后的温度
C.用硝酸银检验产物氯化钠的存在 D.比较反应前后物质的总质量
参考答案:
【答案】 对比,排除水的干扰 与氢氧化钠反应的瓶子变形更大 在反应后的溶液中滴加足量稀盐酸 产生气泡 2Na2CO3+2HCl=2NaCl+CO2↑+H2O AB
【解析】(1). 氢氧化钠溶液中有氢氧化钠和水两种物质,为证明二氧化碳是被氢氧化钠反应掉,所以用图①实验进行对比,排除水的干扰 ; 与氢氧化钠反应的瓶子变瘪,变形严重,盛水的瓶子变形比较小,证明二氧化碳是被氢氧化钠反应掉; 氢氧化钠和碳酸钠的混合物中加入盐酸时,盐酸先与氢氧化钠反应,所以证明碳酸钠时,在反应后的溶液中要滴加足量稀盐酸 如能看到 产生气泡,反应方程式为2Na2CO3+2HCl=2NaCl+CO2↑+H2O (2)向氢氧化钠溶液中加盐酸时,溶液的性质由碱性变至中性,酸过量时,呈酸性,pH变化是由大于7逐渐减小,酸过量时pH大于7,测定反应前后溶液的酸碱度,可证明二者反应了;中和反应放热,测定反应前后的温度,可证明二者能反应;盐酸和氯化钠都能与硝酸银生成白色沉淀,所以不能用硝酸银检验产物氯化钠;据质量守恒定律可知,反应前后物质的总质量不变,不能比较反应前后物质的总质量来验证反应的发生。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体。为确定气体的成分,进行下列实验探究.
(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是________________。
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO
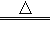 3Cu+N2+3H2O。于是设计了如图实验装置:
3Cu+N2+3H2O。于是设计了如图实验装置:
(3)现象与结论:A中观察到酚酞试剂变为红色,证明有______;B中玻璃管内观察到固体表面由黑色变红色,证明有_______。
(4)实验反思:
①浓硫酸的作用是_________________。
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入混有稀硝酸的________溶液中,无白色沉淀产生,则该气体中_____HCl(填“有”或“无”)。
③请完善Na与NH4Cl溶液反应的化学方程式2Na+2NH4Cl=2NH3↑+H2↑+2________。
(5)已知2.3g的钠与一定量的溶质质量分数为10%的氯化铵溶液正好完全反应,求反应后所得氨气的质量是多少?______
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是配制一定质量分数的NaCl溶液的操作过程。请回答下列问题:
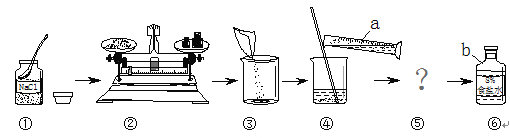
(1)指出图中a、b两种仪器的名称:a___________,b___________。
(2)写出图中的一处错误操作______________________________________。
(3)步骤⑤的操作为溶解,玻璃棒的作用是________,其操作要领是____________________。
(4)若上面溶解得到的NaCl溶液中还含有少量不溶性物质,则步骤⑤还需增加的操作名称是__________;配制溶液时,量取水的时候仰视读数,若其他操作都正确,则配制的NaCl溶液的溶质质量分数_________(填写“偏大”“偏小”或“无影响”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列符号能表示一种元素,又能表示该元素的一个原子,还能表示一种单质的是( )
A. CuO B. Na C. N2 D. O
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中常常会发生一些变化,下列变化属于化学变化的是 ( )
A. 樟脑球在衣柜中渐渐消失
B. 在晾干的咸菜表面出现白色晶体
C. 给电熨斗通电产生热能
D. 吃进的食物一段时间后被消化了
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下说法错误的是
A.煤油燃烧产生火焰和黑烟,化学能转变成热能和光能
B.干电池放电时化学能转变成电能
C.面粉、蔗糖灼烧后都变成炭黑,说明它们是相同的物质
D.化学变化常常伴随着能量变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应前后,一定不变的是 ( )
①分子种类 ②原子种类 ③分子数目 ④原子数目 ⑤各物质的质量总和
A. ①③⑤ B. ①②⑤ C. ②④⑤ D. ②③⑤
相关试题

