【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下图所示。
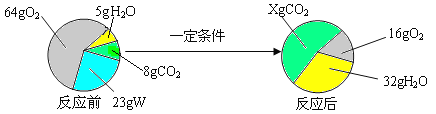
下列关于以上反应的说法中,正确的是
A. X的值为44 B. W由碳、氢两种元素组成
C. 该反应属于置换反应 D. W中碳、氢元素质量比为4∶1
参考答案:
【答案】D
【解析】试题分析:根据质量守恒定律:参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,利用在发生化学反应时反应物质量会减小,生成物质量会增多,判断反应物与生成物,进而书写出反应的表达式,判断反应的类型据此回答问题即可。由于四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是23g+(64g﹣16g)=71g,而水的质量增加,且增加值是32g﹣5g=27g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是71g﹣27g=44g;此反应的表达式可表示为W+O2→CO2+H2O。A、由以上分析知X的值等于44g+8g=52g,故错误;B、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种化合物,不属于置换反应,故错误;C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:27g×![]() =24g,二氧化碳中氧元素的质量:44g×
=24g,二氧化碳中氧元素的质量:44g×![]() =32g,两者的质量和为56g,而参加反应的氧气的质量=64g﹣16g=48g,所以可判断W中含有氧元素,故错误;D、由C的分析可知W中碳、氢元素质量比为(44g﹣32g):(27g﹣24g)=4:1,故正确,故选D。
=32g,两者的质量和为56g,而参加反应的氧气的质量=64g﹣16g=48g,所以可判断W中含有氧元素,故错误;D、由C的分析可知W中碳、氢元素质量比为(44g﹣32g):(27g﹣24g)=4:1,故正确,故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组同学为了弄清即将维修的沼气池中气体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【收集气体】将不加盖的矿泉水瓶装满水,用细绳吊入池中,再用木棍拨动使瓶中的水全部倒出(见图),然后迅速拉起矿泉水瓶,盖上瓶盖。

这种方法属于____________集气法。
【对气体猜想】猜想Ⅰ:全部是CH4; 猜想Ⅱ:全部是CO;
猜想Ⅲ:全部是CO2; 猜想Ⅳ:是CH4和CO2的混合气体。
【实验和推断】

⑴若“现象a”为石灰水变浑浊,则说明气体中含有_____气体。
⑵步骤②的目的是____________________________________;步骤③“注水装置”应选下图中的____________(填序号)。

⑶若“现象b”为杯壁有水雾出现,有同学认为“猜想Ⅰ或Ⅳ”成立,其反应方程式为:____________; 另有同学认为此现象不能证明收集到的气体中一定含有氢元素,理由是_______________;要排除这种干扰可采取的措施是______________________________。
⑷ 采取⑶中的排除干扰措施后:若“现象a、b”为无明显现象,“现象c”为石灰水变浑浊,则证明“猜想_________”成立;若“现象a、c”均为石灰水变浑浊,“现象b”为杯壁有水雾,则证明“猜想__________”成立。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国女科学家屠呦呦获2015年诺贝尔生理学或医学奖。她最初的发现,让青蒿素(化学式:C15H22O5)成为世界卫生组织推荐的一线抗疟药,挽救了全球数百万人的生命。而下图是某厂生产的青蒿素的说明书部分内容。
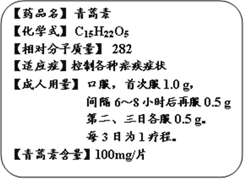
⑴青蒿素属于____________化合物(填“有机”或“无机”)
⑵青蒿素含有____________种元素;碳、氧的原子个数比为____________(填最简比)。
⑶青蒿素中氢元素的质量分数是_________(精确到0.1%)。
⑷用青蒿素控制疟疾症状一般以三天为1个疗程。根据图中说明,一个成人疟疾患者在一个疗程中共需服该药物____片。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入溶质质量分数为26.5%的碳酸钠溶液,测得溶液pH随加入碳酸钠溶液质量的变化曲线如下图所示。
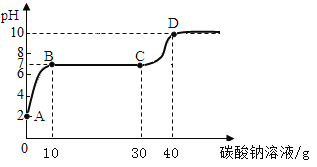
回答下列问题:
⑴A点处溶液中溶质的化学式是CaCl2和______________;
⑵计算原滤液中氯化钙的质量分数为_____________(写出计算过程,结果精确到0.1%)。
⑶根据计算所得数据在下图中画出产生沉淀的曲线。
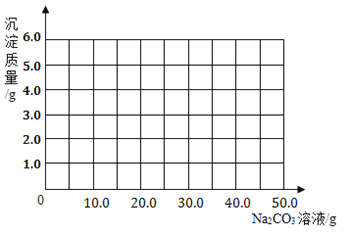 _______________
_______________⑷CD段pH上升的原因是________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示,请结合图表数据回答下列问题:
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶
(1)下图表示________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。
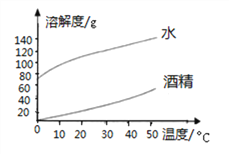
(2)温度从20℃升到40℃时,氢氧化钠在水中的溶解度变化__________(填“大于”或“小于”)碳酸钠在水中的溶解度变化。
(3)40℃ 时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的溶剂是__,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为______________。
(4)若要对比两种固体物质的溶解性,必须在_____________、______________ 、_____________的条件下进行对比。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示四种液体或溶液中存在的粒子示意图。(图中粒子个数不代表实际粒子数目关系)
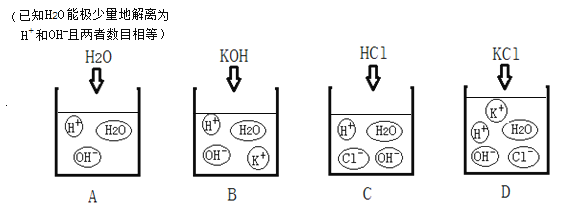
请回答。
(1)在烧杯A、B、C中分别滴入2-3滴酚酞溶液,烧杯______(填字母编号)的溶液变红。
(2)若烧杯D的溶液是另取一定量的烧杯B、C 中的溶液混合后得到的,再向其中滴入酚酞溶液不变红,小明推断是氢氧化钾与盐酸恰好完全反应了。小红则提出该推断_____(填“正确”或“不正确”),理由是_____________________。烧杯D 中水分子的数目一定______(填“大于”或“等于”或“小于”)烧杯B、C中的水分子数目之和。
(3)四个烧杯中能证明使酚酞变红的粒子不是K+的是_____________________(填字母编号)。
依据烧杯A、B、C中滴入酚酞溶液后的现象,请从微观角度解释酚酞溶液遇液体或溶液变红的原因是_______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下几个反应阶段:①原料氯化钠与浓硫酸在高温下反应得到产物硫酸钠和氯化氢气体,②在1000℃条件下通过硫酸钠与木炭反应生成硫化钠和二氧化碳,③生成的硫化钠继续和碳酸钙反应来得到碳酸钠。请完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的质量是_________kg。
(2)反应②中碳单质过量时也同样可以反应获得Na2S,此时所发生的反应化学方程式是_______。
相关试题

