【题目】某同学设计了如下图所示的装置,用于实验室制取CO2,并对它的部分性质进行探究,按要求回答问题。

(1)A装置用于制取CO2,反应的化学方程式为___________________。
(2)用B装置收集CO2,气体应从___________(选填“a”或“b”)端通入;
(3)若要C中的两个气球悬浮在空气中,则气体甲可能是_________(填序号);
A.氢气 B.氧气 C.空气
(4)往D试管中通入CO2,当出现__________现象,表示石灰水中的溶质恰好完全沉淀;
(5)E装置的集气瓶中充满CO2,打开分液漏斗①,滴入少量NaOH浓溶液,气球明显胀大,写出发生反应的化学方程式__________;若要气球恢复原状,应关闭分液漏斗①,打开分液漏斗②,滴入___________溶液(填化学式,忽略滴入液体体积)。
参考答案:
【答案】 CaCO3+2HCl=CaCl2+H2O+CO2↑ a A 溶液红色刚好消失 CO2+2NaOH= Na2CO3+H2O HCl/H2SO4
【解析】(1)该装置用碳酸钙和稀盐酸制取二氧化碳,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)b装置是多功能装置,此处改装为向上排空气法收集二氧化碳,故气体从a管通入;
(3)若要C中的两个气球悬浮在空气中,则里面装的气体的密度比空气的密度小,故选A;
(4)氢氧化钙溶液显碱性,故酚酞显红色,当氢氧化钙与二氧化碳恰好完全反应时溶液显中性,酚酞变为无色,故当观察到溶液的红色刚刚消失,说明石灰水中的溶质恰好完全沉淀;
(5)气球明显胀大是由于氢氧化钠与二氧化碳反应生成碳酸钠和水,使内压降低而引起的,该反应的方程式为CO2+2NaOH= Na2CO3+H2O ;
(6)反应生成了碳酸钠,可以加入HCl/H2SO4,使碳酸钠反应生成二氧化碳气体;
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验: (电子秤示数单位为克)
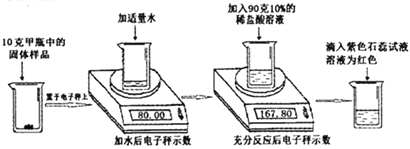
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈____性。
(2)上述实验中产生的二氧化碳气体质量为______克。
(3)计算甲瓶固体样品中碳酸钠的质量分数____________。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
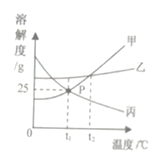
A. 甲的溶解度大于乙的溶解度
B. 降温可使接近饱和的丙溶液变为饱和溶液
C. 将t2°C甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数:乙>甲=丙
D. P点表示t1℃时甲、丙两种物质的溶解度都是25g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列选项中相关量的变化与图像不相符的是
选项
X
Y

A.向一定量饱和食盐水中加水
水的质量
溶质质量
B.向一定量锌粒中加稀硫酸
稀硫酸质量
氢气质量
C.向一定量CuCl2溶液中加NaOH溶液
NaOH溶液质量
沉淀质量
D.向一定量水中加KNO3晶体
KNO3晶体质量
溶质质量分数
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】联系已学的化学知识,回答下列问题。
(1)空气中能供给呼吸的气体是_________________;
(2)熄灭酒精灯用灯帽盖灭,其灭火原理是_______________。
(3)标出水中氢元素的化合价_____________。
(4)铁制容器不能盛放硫酸铜溶液的原因_______________(用化学方程式表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验课上,老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种,为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。
[提出猜想]甲组:铜粉;乙组:氧化铁粉末;丙组:____________________。
[设计实验]
方案1:取少量红色粉末放入试管中,滴加足量的___________(从下列试剂中选择:氯化钠溶液、稀盐酸、氢氧化钠溶液)振荡,若甲组猜想正确,则实验现象为__________________。
方案2:取8g红色粉末放入硬质玻璃管中,先通入CO,然后用酒精喷灯加热一段时间(实验装置如图1所示),停止加热并继续通入CO至装置冷却。
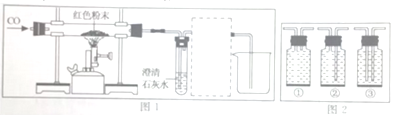
若乙组或丙组猜想正确,则硬质玻璃管内发生反应的化学方程式是____________。
实验时要先通CO再加热的目的是______________________。
[数据处理]
等装置完全冷却到室温,称量硬质玻璃管内剩余固体质量为mg。若乙组猜想正确,则m的取值范围是________________。
[实验反思]
图1虚线框内的装置是用于吸收CO2;并收集CO,请从图2(广口瓶内均为氢氧化钠溶液)中选择最合适的装置______________(填序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一一种溶质),取废水样品200g,逐滴加入溶质质量分数为5%的氢氧化钠溶液,废水中硫酸的质量随加入氢氧化钠溶液质量变化如下图所示,

(1)要配制100g5%的氢氧化钠溶液,需氢氧化钠固体质量为___________g;
(2)计算该废水中硫酸的质量分数为_____________(写出计算过程)。
相关试题

