【题目】实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验: (电子秤示数单位为克)
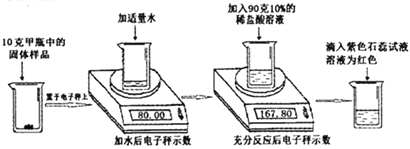
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈____性。
(2)上述实验中产生的二氧化碳气体质量为______克。
(3)计算甲瓶固体样品中碳酸钠的质量分数____________。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因__________。
参考答案:
【答案】 酸 2.2 53% 用100g15%的稀硫酸进行实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
【解析】本题考查了根据化学方程式进行计算。根据质量守恒分析得到二氧化碳的质量,根据二氧化碳的质量结合化学方程式计算样品中碳酸钠的质量,进一步计算固体样品中碳酸钠的质量分数。
(1)紫色石蕊试液遇酸性溶液变红色,滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈酸性。
(2)根据质量守恒,产生的二氧化碳气体质量为80.00g+90g-167.80g=2.2g;
(3)设固体样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
![]() x=5.3g
x=5.3g
固体样品中碳酸钠的质量分数=![]() ×100%=53%;
×100%=53%;
(4)若样品完全变质,样品全部变成碳酸钠。
设:与10g碳酸钠反应需硫酸的质量为y,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 98
10g y
![]() y=9.25g,所需稀硫酸的质量=
y=9.25g,所需稀硫酸的质量=![]() =61.64g。61.64g<100g,稀硫酸过量;
=61.64g。61.64g<100g,稀硫酸过量;
若样品没有变质,样品中有10g的氢氧化钠。
设:与10g氢氧化钠反应需硫酸的质量为z,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
10g z
![]() z=12.25g,所需稀硫酸的质量=
z=12.25g,所需稀硫酸的质量=![]() =81.67g。81.67g<100g,稀硫酸过量;
=81.67g。81.67g<100g,稀硫酸过量;
所以不管固体样品变质程度如何,加入100g15%稀硫酸后,稀硫酸一定过量。他做出此判断的原因是用100g15%的稀硫酸进行实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
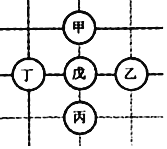
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】小敏对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”
(1)小敏认为的“铁”是指______(选填“铁元素”或“铁单质”)。
(2)通过Fe2O3+3CO
 2Fe+3CO2可以把铁矿石中的铁元素转变成铁单质,此反应利用了CO的______性。
2Fe+3CO2可以把铁矿石中的铁元素转变成铁单质,此反应利用了CO的______性。 -
科目: 来源: 题型:
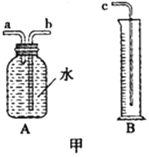
查看答案和解析>>【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号
盐酸溶液浓度
2分钟内产生氢气的体积
1
5%
10mL
2
15%
28mL
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
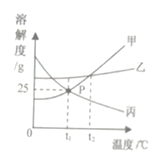
A. 甲的溶解度大于乙的溶解度
B. 降温可使接近饱和的丙溶液变为饱和溶液
C. 将t2°C甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数:乙>甲=丙
D. P点表示t1℃时甲、丙两种物质的溶解度都是25g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列选项中相关量的变化与图像不相符的是
选项
X
Y

A.向一定量饱和食盐水中加水
水的质量
溶质质量
B.向一定量锌粒中加稀硫酸
稀硫酸质量
氢气质量
C.向一定量CuCl2溶液中加NaOH溶液
NaOH溶液质量
沉淀质量
D.向一定量水中加KNO3晶体
KNO3晶体质量
溶质质量分数
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学设计了如下图所示的装置,用于实验室制取CO2,并对它的部分性质进行探究,按要求回答问题。

(1)A装置用于制取CO2,反应的化学方程式为___________________。
(2)用B装置收集CO2,气体应从___________(选填“a”或“b”)端通入;
(3)若要C中的两个气球悬浮在空气中,则气体甲可能是_________(填序号);
A.氢气 B.氧气 C.空气
(4)往D试管中通入CO2,当出现__________现象,表示石灰水中的溶质恰好完全沉淀;
(5)E装置的集气瓶中充满CO2,打开分液漏斗①,滴入少量NaOH浓溶液,气球明显胀大,写出发生反应的化学方程式__________;若要气球恢复原状,应关闭分液漏斗①,打开分液漏斗②,滴入___________溶液(填化学式,忽略滴入液体体积)。
相关试题

